摘要:(1)K = (2)167mol/L·min (3)① 减小 c ② f (4)见右图
网址:http://m.1010jiajiao.com/timu3_id_401680[举报]
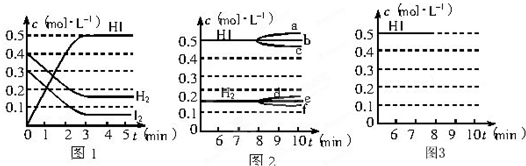
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g),△H<0反应中各物质的浓度随时间的变化情况如图1所示.试回答下列问题:
(1)该反应的化学平衡常数的表达式为
.
(2)根据图1数据,反应开始至达到平衡时,反应的平均速率v(HI)为
(3)反应达到平衡后,第8min时:①若升高温度,化学平衡常数K
②若加入I2,H2浓度的变化正确的是
(4)反应达到平衡后,第8min时,若把容器的容积扩大一倍,请在图3中画出第8min后HI浓度的变化情况.
查看习题详情和答案>>

(1)该反应的化学平衡常数的表达式为
| c2(HI) |
| c(H2)c(I2) |
| c2(HI) |
| c(H2)c(I2) |
(2)根据图1数据,反应开始至达到平衡时,反应的平均速率v(HI)为
0.167mol/(L?min)
0.167mol/(L?min)
.(3)反应达到平衡后,第8min时:①若升高温度,化学平衡常数K
减小
减小
(填“增大”、“减小”或“不变”),HI的浓度变化正确的是c
c
(用图2中的a~c的编号回答).②若加入I2,H2浓度的变化正确的是
f
f
(用图2中的d~f的编号回答).(4)反应达到平衡后,第8min时,若把容器的容积扩大一倍,请在图3中画出第8min后HI浓度的变化情况.
(2013?重庆一模)如图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料.

请填写下列空白:
(1)在周期表中,组成单质G的元素的位置:
(2)在反应⑨中还原剂与氧化剂的物质的量之比为
(3)在反应②.③.⑥.⑧中,既属于化合反应又属于氧化还原反应的是
(4)反应④的离子方程式是:
反应⑦的化学反应方程式:
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.该反应的化学方程式是:
查看习题详情和答案>>

请填写下列空白:
(1)在周期表中,组成单质G的元素的位置:
第四周期第Ⅷ族
第四周期第Ⅷ族
.(2)在反应⑨中还原剂与氧化剂的物质的量之比为
2:1
2:1
.(3)在反应②.③.⑥.⑧中,既属于化合反应又属于氧化还原反应的是
②.⑧
②.⑧
(填写序号).(4)反应④的离子方程式是:
Fe2++4H++NO3-=3Fe3++NO↑+2H2O
Fe2++4H++NO3-=3Fe3++NO↑+2H2O
反应⑦的化学反应方程式:
2Al+Fe2O3
2Fe+Al2O3
| ||
2Al+Fe2O3
2Fe+Al2O3
| ||
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.该反应的化学方程式是:
Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O
Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O
.