25. (10分)(Ⅰ)(3分)下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”。
(10分)(Ⅰ)(3分)下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”。
(1)doggycene的分子式为________________。
(2)1mol该物质在氧气中完全燃烧生成CO2和水的物质的量
之比为______。
(3)该分子中所有碳原子__________(填“可能”或“不可能”)处于同一平面。
(Ⅱ)(7分)分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
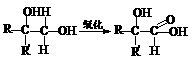
。 为了合成惕各酸苯乙酯,某实验室的科技人员设计了下列合成路线:
|
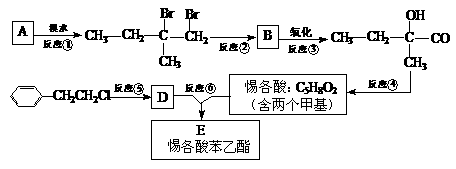
试回答下列问题:
(1)用系统命名法命名A的名称为_____________;B的结构简式为_______________。
(2)反应②中另加的试剂是_______________;在惕各酸同分异构体中,含“C=C”甲酸的酯共有_______种。
(3)试写出反应⑥的化学方程式:______________ __________________。
(4)上述合成路线中属于消去反应的是 (填编号)。
 (3)磺胺类药物,常用于肠道抗菌感染的治疗,工业上可用苯为原料通过下列反应制得磺胺。(转化关系中-H2O、-HCl、-CH3COOH分别表示反应中有H2O、HCl、CH3COOH生成)
(3)磺胺类药物,常用于肠道抗菌感染的治疗,工业上可用苯为原料通过下列反应制得磺胺。(转化关系中-H2O、-HCl、-CH3COOH分别表示反应中有H2O、HCl、CH3COOH生成)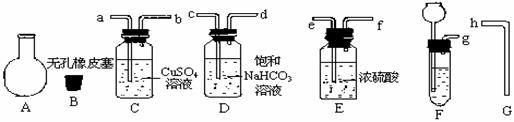
 ,反应经5分钟达到平衡,测得此时A的浓度减小了a mol/L,而C的浓度增加了
,反应经5分钟达到平衡,测得此时A的浓度减小了a mol/L,而C的浓度增加了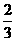 a mol/L,又知平均反应速率:v (C) =2v (B)。
a mol/L,又知平均反应速率:v (C) =2v (B)。

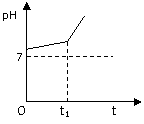 (2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。
(2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。 (12分)某同学利用废铁屑(含有Cu等与盐酸不反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有mg铁粉,烧杯中放有过量的稀硝酸。实验时,打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液为浅绿色,再打开b进行过滤;过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体,填写下列空白:
(12分)某同学利用废铁屑(含有Cu等与盐酸不反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有mg铁粉,烧杯中放有过量的稀硝酸。实验时,打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液为浅绿色,再打开b进行过滤;过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体,填写下列空白: 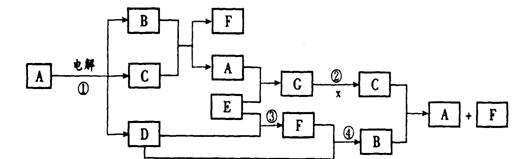 (8分)下图是一些常见物质间的转化关系图,图中所有物质含有的元素中只有一种不是短周期元素,所有反应物、生成物及溶液中的水均未标出,反应②中还有3种产物未标出,x是室内装潢材料中产生的主要有害气体之一,G是由四种元素组成的强碱。
(8分)下图是一些常见物质间的转化关系图,图中所有物质含有的元素中只有一种不是短周期元素,所有反应物、生成物及溶液中的水均未标出,反应②中还有3种产物未标出,x是室内装潢材料中产生的主要有害气体之一,G是由四种元素组成的强碱。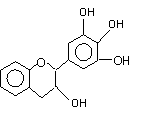 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是 ( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是 ( )
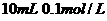 氨水与
氨水与
 溶液与
溶液与
 溶液混合,
溶液混合,
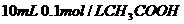 溶液与
溶液与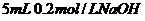 溶液混合,
溶液混合,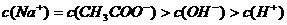
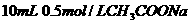 溶液与
溶液与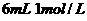 盐酸混合,
盐酸混合,