摘要: 在密闭容器中进行如下反应:.反应经5分钟达到平衡.测得此时A的浓度减小了a mol/L.而C的浓度增加了a mol/L.又知平均反应速率:v . (1)写出上述化学方程式中各物质的系数:m = .n = .p = . (2)压强一定时.C的百分含量与温度.时间的关系如右图所示. 由此可知.该反应为 反应. (3)该反应的平衡常数表示式为 ,升高温度.K值将 (填“增大 .“减小 或“不变 ). (4)以下图1.图2均表示该反应在t1时达到平衡.在t2时改变某条件发生变化的曲线. 试判断.图1中t2时改变的条件是 ,图2中t2时改变的条件是 .
网址:http://m.1010jiajiao.com/timu3_id_401417[举报]
在密闭容器中进行如下反应:

 ,已知
,已知 的起始浓度分别为0.1moL/L、0.3mol/L,0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
的起始浓度分别为0.1moL/L、0.3mol/L,0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
[ ]
A.Z为0.3mol/L
B. 为0.35mol/L
为0.35mol/L
 为0.35mol/L
为0.35mol/LC. 为0.2mol/L
为0.2mol/L
 为0.2mol/L
为0.2mol/LD.Z为0.4mol/L
在密闭容器中进行如下反应: ,已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
,已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
 ,已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
,已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是[ ]
A.Z为0.3mol/L
B.Y2为0.35mol/L
C.X2为0.2mol/L
D.Z为0.4mol/L
查看习题详情和答案>>
B.Y2为0.35mol/L
C.X2为0.2mol/L
D.Z为0.4mol/L


 ,已知
,已知 的起始浓度分别为0.1moL/L、0.3mol/L,0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
的起始浓度分别为0.1moL/L、0.3mol/L,0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 为0.35mol/L
为0.35mol/L 为0.2mol/L
为0.2mol/L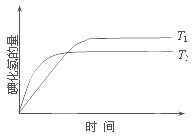 在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )