20.(16分)钢铁工业是国家工业的基础。铁及铁的化合物应用广泛,如钢铁用于建筑机械等,FeCl3可用于催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)钢铁吸氧腐蚀正极反应为____________________________________;
(2)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________________。
(3)腐蚀铜板后的混合溶液中,若要除去Cu2+中的Fe3+和Fe2+,请参照下表给出的数据和药品,除去CuCl2溶液中Fe3+和Fe2+的实验步骤 是①用试剂X将Fe2+氧化成Fe3;②加入CuO调节溶液的pH至3.2-4.7;③过滤除去Fe(OH)3。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:X试剂、浓H2SO4、NaOH溶液、CuO、Cu, |
X试剂可以是( )
A.氯气 B.双氧水 C.高锰酸钾 D.次氯酸钠
(4)取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
I |
II |
III |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
 A.R是三肽
A.R是三肽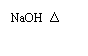 A. 卤代烃水解
A. 卤代烃水解  → C2H5OH+HCl
→ C2H5OH+HCl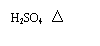 B.酯的水解
B.酯的水解