28.(13分)乙醛是重要的化工原料和化学试剂。实验室可用乙醇制乙醛,工业上目前使用两种方法制取乙醛:(1) 乙炔水化法 (2) 乙烯氧化法。两种制法制乙醛的有关信息见下表:
|
物质 项目 |
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100℃-125℃ |
PdCl2-CuCl2 100℃-125℃ |
|
平衡转化率 |
乙炔转化率 90% |
乙烯转化率 80% |
|
日产量 |
2.5t(某设备条件下) |
3.6t(相同设备条件下) |
|
原料来源生产工艺 |
CaCO3 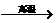 CaO CaO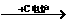 CaC2 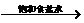 C2H2 C2H2 |
石油裂解气 |
(1) 写出下列化学方程式:
实验室乙醇制乙醛__________________________________________________
乙炔水化法制乙醛__________________________________________________
(2) 将乙醛滴入新制的氢氧化铜悬浊液并加热,其现象是____________________________,反应的化学方程式为_____________________________________________。
(3) 比较两种乙醛的工业制法,从化学反应速率的角度分析,在相同的条件下,较快的是__________(填字母)
(A) 乙炔水化法 (B) 乙烯氧化法
(4)乙烯由石油裂化气进一步催化裂解而来。裂解气中各成分的体积百分含量分别为:甲烷5%、乙烯40%、丙烯10%、丁二烯7%、硫化氢2%、氢气36%。如将上述裂解气通入溴水中,观察到的现象为__________________________________________。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为____________(精确到0.1)。
(5) 现代工业上乙烯氧化法有逐步取代乙炔水化法的趋势,试通过表中提供的信息,说出其中的两个原因:_________________________________、____________________________
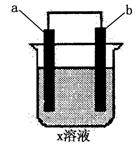
19.下列对如图所示装置实验现象的描述正确的是 ( )
|
|
b电极 |
a电极 |
x溶液 |
实验现象 |
|
A |
石墨 |
石墨 |
CuCl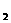 |
a极质量增加,b极放出无色气体 |
|
B |
Fe |
石墨 |
KNO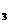 |
a极质量增加,b极放出无色气体 |
|
C |
Fe |
Cu |
CuSO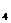 |
a极质量增加,b极质量减少 |
|
D |
石墨 |
石墨 |
HCl |
a、b极都放出无色气体 |
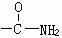 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为: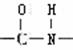 (4)显中性
。
(4)显中性
。

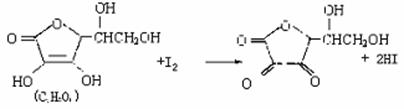 23.(11分)维生素C(C6H8O6)(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果蔬菜、乳制品中都富含维生素C。如新鲜橙汗中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙法中维生素C的含量,其反应原理为:
23.(11分)维生素C(C6H8O6)(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果蔬菜、乳制品中都富含维生素C。如新鲜橙汗中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙法中维生素C的含量,其反应原理为: (CH3)2C=O + HCN
(CH3)2 C(OH)CN
(CH3)2C=O + HCN
(CH3)2 C(OH)CN (CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C (CH3)COOCH3
+ NH4HSO4
(CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C (CH3)COOCH3
+ NH4HSO4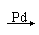 90年代新法的反应是:CH3C≡CH + CO + CH3OH CH2=C (CH3)COOCH3与旧法比较,新法的优点是: ( )
90年代新法的反应是:CH3C≡CH + CO + CH3OH CH2=C (CH3)COOCH3与旧法比较,新法的优点是: ( )