1.4 2.1 0.6 1.2
等价转化 2 4
另:若△V=0,直接看出x=1,再由投料比求出a、b
例3.在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g) 2HBr(g),已知加入1molH2和2molBr2时,达到平衡后生成amolHBr(见表)。在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号的状态,填写:
2HBr(g),已知加入1molH2和2molBr2时,达到平衡后生成amolHBr(见表)。在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号的状态,填写:
|
编号 |
起始状态mol |
平衡时HBr物质的量mol |
||
|
H2 |
Br2 |
HBr |
||
|
已知 |
1 |
2 |
0 |
a |
|
1 |
2 |
4 |
0 |
2a |
|
2 |
0 |
0.5 |
1 |
0.5a |
|
3 |
m |
n(n≥2m) |
2n-4m |
(n-m)a |
解析:放大缩小模型,可知对H2(g)+Br2(g)→2HBr(g),1molH2+2molBr2与kmolH2+2kmolBr2在同温同压下一定可达“等百分含量”即等效平衡,后者平衡时生成了kamolHBr
H2(g)+Br2(g)→2HBr(g)
1 2 a
k 2k ka
① 即k=2,∴HBr:2amol
② 即k=0.5,需0.5molH2+1molBr2 等价转化∽ 0.5amolHBr――应达到
而1molHBr ∽ 0.5molH2+0.5molBr2 起始等效
∴0.5molH2+1molBr2 ∽ 0 molH2+0.5molBr2+1molHBr(比较得出)
③ 设最初m molH2+n molBr2+x molHBr
而x molHBr ∽ 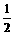 x molH2+
x molH2+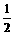 x molBr2
x molBr2
∴m molH2+n molBr2+x
molHBr ∽ (m+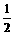 x)molH2+(n+
x)molH2+(n+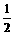 x)molBr2
x)molBr2
且(m+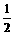 x)∶(n+
x)∶(n+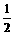 x)=1∶2平衡时生成(m+
x)=1∶2平衡时生成(m+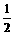 x)amol HBr
x)amol HBr
解得x=2(n-2m)
∴x代入(m+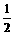 x)a(即现在的k)=(n-m)a
x)a(即现在的k)=(n-m)a
例4.向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(气)+ 3 H2(气) 2 NH3(气),平衡时混合气共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2 NH3(气),平衡时混合气共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
①.若a=0,b=0,则c= 4 .
②.若a=0.7,b=2.1,则:
Ⅰ.c= 2.6 .
Ⅱ.这时反应向 逆反应 进行.
Ⅲ.若要维持反应开始向该反应方向进行,c的范围是 1<c≤4 .
③.欲使起始反应维持向与②相反的方向进行,则b的范围是 4.5<b≤6 .
分析:②:符合题设条件的各起始量之差应与反应式中相应系数成比例.
 Ⅰ. N2(气)+ 3 H2(气) 2 NH3(气)
Ⅰ. N2(气)+ 3 H2(气) 2 NH3(气)
起始 2 6 0
条件 0.7 2.1 c
≡ 0.7+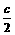 =2, ∴c=2.6
=2, ∴c=2.6
Ⅱ.题设条件平衡时共7 mol气体,而②小题起始量才5.4 mol(0.7+2.1+2.6),所以起始方向向逆反应进行.
Ⅲ.从三个极限起始量考虑,即N2转化率等于0时,2 mol N2、6 mol H2、NH3=0;N2转化率等于100%时,N2=0、H2=0、NH3=4 mol;现求平衡时各成分的物质的量
 N2(气)+ 3 H2(气) 2 NH3(气)
N2(气)+ 3 H2(气) 2 NH3(气)
2 6 0
x 3x 2x
2-x 6-3x 2x
依题意:(2-x)+(6-3x)+ 2x = 7,x = 0.5
所以平衡时,N2=1.5 mol、H2=4.5 mol、NH3=1 mol
将三个极限起始量加以分析对比:
 N2(气)+ 3 H2(气) 2 NH3(气)
N2(气)+ 3 H2(气) 2 NH3(气)
2 6 0 (N2转化率为0时起始量)
 2A(g)+B(g)
3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
2A(g)+B(g)
3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( ) 设E为x mol。当x在一定范围内变化时,均可通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置,请填写以下空白:
设E为x mol。当x在一定范围内变化时,均可通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置,请填写以下空白: 例1.在一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g) 2C(g),达到平衡时,C的物质的量浓度为K mol/L,若维持容器体积和温度不变,按下列配比作为起始物质, A.4 molA+2 molB
B.2 molA+1
molB+2 molC
例1.在一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g) 2C(g),达到平衡时,C的物质的量浓度为K mol/L,若维持容器体积和温度不变,按下列配比作为起始物质, A.4 molA+2 molB
B.2 molA+1
molB+2 molC  例2.可逆反应2A(g)+3B(g) xC(g)+4D(g)。若按下列两种配比:①0.8molA、1.2molB、1.2molC、2.4molD;②a
molA、b molB、0.6molC、1.2molD将它们放入一个容积不变的密闭容器中,保持温度不变,达到平衡后,C的百分含量相同,则a=_1.4__,b=_2.1_,方程式中C的计量数为_2_。
例2.可逆反应2A(g)+3B(g) xC(g)+4D(g)。若按下列两种配比:①0.8molA、1.2molB、1.2molC、2.4molD;②a
molA、b molB、0.6molC、1.2molD将它们放入一个容积不变的密闭容器中,保持温度不变,达到平衡后,C的百分含量相同,则a=_1.4__,b=_2.1_,方程式中C的计量数为_2_。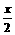 ×0.8+1.2) (2×0.8+2.4)
×0.8+1.2) (2×0.8+2.4)