网址:http://m.1010jiajiao.com/timu3_id_371829[举报]
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)A、B、D、E四种元素组成的某无机化合物浓度为 0.1 mol/L时, pH最接近 。
A.5.6 B.7.0 C.8.4 D.13.0
(4)化学反应3A2(g)+C2(g)![]() 2CA3(g)。ΔH=-92.4kJ·mol-1
2CA3(g)。ΔH=-92.4kJ·mol-1
|
和CA3的量),右图表示反应速率与反应过程的关
系,其中表示平衡混合物中CA3的含量最高的一段
时间是 。
②温度为T℃时,将4amolA2和2a molC2放入1L
密闭容器中,充分反应后测得C2的转化率为50%,
则反应的平衡常数 。
③在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molC2和3molA2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是________ ____;
(5)已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65 kJ
的热量。写出该反应的热化学方程式 。
查看习题详情和答案>>室温下,将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应:2A(气)+B(气) XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
②反应前容器内的压强与平衡后容器内的压强之比为1:1
③ 2 s 时物质A的转化率为30%
④ X="2"
⑤室温下该反应的化学反应平衡常数是0.5
⑥其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
其中正确的是( )
| A.①③④ | B.①④⑥ | C.②③⑤ | D.③⑤⑥ |
室温下,将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应:2A(气)+B(气)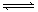 XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
②反应前容器内的压强与平衡后容器内的压强之比为1:1
③ 2 s 时物质A的转化率为30%
④ X="2"
⑤室温下该反应的化学反应平衡常数是0.5
⑥其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
其中正确的是( )
A.①③④ B.①④⑥ C.②③⑤ D.③⑤⑥
查看习题详情和答案>>
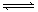 XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
②反应前容器内的压强与平衡后容器内的压强之比为1:1
③ 2 s 时物质A的转化率为30%
④ X="2"
⑤室温下该反应的化学反应平衡常数是0.5
⑥其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
其中正确的是( )
| A.①③④ | B.①④⑥ | C.②③⑤ | D.③⑤⑥ |
室温下,将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为 1.4 mol,现有下列几种说法:
XC(气),经 2 s(秒)后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为 1.4 mol,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 反应前容器内的压强与平衡后容器内的压强之比为1:1
③ 2 s 时物质A的转化率为30%
④ X=2
⑤ 室温下该反应的化学反应平衡常数是0.5
⑥其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
其中正确的是( )
A.①③④ B.①④⑥ C.②③⑤ D.③⑤⑥
查看习题详情和答案>>
