25.(10分)铝是国民经济发展的重要材料, 铝在地壳中含量约占8%,目前我国铝消费超过430万吨,在众多的金属中仅次于钢铁。
(1)工业上制取铝的流程图如下:

在制取氧化铝中,分析铝土矿和赤泥所得数据如下:
|
|
Al2O3 |
Fe2O3 |
NaOH |
其它杂质 |
|
铝土矿 |
55% |
16% |
0 |
/ |
|
赤泥 |
15% |
48% |
8% |
/ |
设其它杂质不参加反应,则每生产1 t 纯净氧化铝,需铝土矿的质量为 吨, 投入的烧碱固体为 吨。
(2)国家行业标准中铸造铝合金的各成分的质量分数为:Si-4.5%-5.5%,Cu-1.0%-1.5%,Mg-0.4%-0.6%,其余为Al。现对某铸造铝合金产品的质量进行如下实验检测:①称取18.0g铸造铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)
②待两份反应物都充分反应之后,称得滤渣质量相差0.512g,收集得到的两份气体的体积相差851.2mL(标准状况下)。
请通过计算判断该品牌的铸造铝合金是否为合格产品。
23.(10分) 不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
电负性值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
观察上述数据,回答下列问题:
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围 。
(2)请归纳元素的电负性和金属、非金属的关系是 ;
(3)某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称)。
(4)从电负性角度,判断AlCl3是离子化合物,还是共价化合物的方法是:(写出判断的方法和结论) ;请设计一个实验方案证明上述所得到的结论: 。

 2C(g);反应达到平衡后,再恢复至原温度。
2C(g);反应达到平衡后,再恢复至原温度。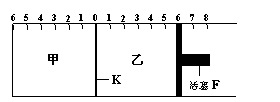 回答下列问题:
回答下列问题: