23.(8分)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
|
H:2.1 |
|
|
|
|
|
|
|
Li:1.0 |
Be:1.5 |
B:2.0 |
C:2.5 |
N:3.0 |
O:3.5 |
F:4.0 |
|
Na:0.9 |
Mg:1.2 |
Al:1.5 |
Si:1.8 |
P:2.1 |
S:2.5 |
Cl:3.0 |
|
K:0.8 |
Ca:1.0 |
Ga:1.6 |
Ge:1.8 |
As:2.0 |
Se:2.4 |
Br:2.8 |
|
Rb:0.8 |
Sr:1.0 |
In:1.7 |
Sn:1.8 |
Sb:1.9 |
Te:χ |
I:2.5 |
|
Cs:0.7 |
Ba:0.9 |
Tl:1.8 |
Pb:1.9 |
Bi:1.9 |
Po:2.0 |
At:2.2 |
|
Fr:0.7 |
Ra:0.9 |
|
|
|
|
|
回答下列问题:
(1)纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解: ;
(2)预测Te元素χ的值 ;
(3)你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小? ;
(4)大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程
。
22.将化学知识系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
 问题1:从不同的角度,化学反应可以有不同的分类方法。四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在右图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系。
问题1:从不同的角度,化学反应可以有不同的分类方法。四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在右图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系。
问题2:不同化学反应进行的快慢和程度千差万别。反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)。
|
序号 |
实际生产中采取的措施 |
工业生产实例(写名称) |
|
(1) |
通过增大压强提高原料转化率 |
|
|
(2) |
使用催化剂增大反应的速率 |
|
问题3:化学反应中均伴随着能量的变化。如果一个化学
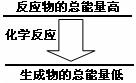 反应中,反应物的总能量和生成物的总能量有如图所示的
反应中,反应物的总能量和生成物的总能量有如图所示的
关系,则该反应过程中的能量变化是
(填“吸热”或“放热” )。
已知热化学方程式为:
C(g) + O2(g)= CO2 (g) △H= -393.5KJ/mol
H2 (g) + 1/2O2 (g)= H2O (l) △H= -285.8KJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是 (保留1位小数)。
问题4:化学反应的发生是有条件的。反应物相同,反应的条件不同,反应的原理不同。如:4Na+O2=2Na2O 2Na+O2 Na2O2 ;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,反应的原理不同:
。
Na2O2 ;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,反应的原理不同:
。
20.(8分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层电子数比次外层多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;D和E的原子序数和为30;在元素周期表中,C是E的不同周期邻族元素。五种元素两两形成的化合物有甲、乙、两、丁四种分子中原子个数比如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素原子个比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
(1)写出元素符号:B E
(2)A元素某原子核内中子数比质子数多1,则该核素的组成符号为_____。
物质丁的分子为 分子(填“极性”或“非极性”)。
(3)向甲的水溶液中加入MnO2,氧化产物是 。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为__________________________________________________
18.(6分)已知a、b、c、d、e分别是Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种物质水溶液中的各一种。它们互相反应的情况如下表所示
|
|
a |
b |
c |
d |
e |
|
c |
↓ |
↓ |
╱ |
↑ |
- |
|
b |
↓ |
╱ |
↓ |
- |
- |
“↓”表示生成沉淀;“↑”表示产生气体;“-”表示无明显现象;“╱”表示实验未做。
则c 是 e是 (均填化学式)
19.(10分)欲配制500 mL0.2 mol·L-1的碳酸钠溶液,回答下列问题:
(1)通过计算可知,应用托盘天平称取 g碳酸钠。
(2)称量的操作顺序为(填序号) 。
A、调天平零点 B、将砝码归盒,游码归零 C、向小烧杯中加碳酸钠
D、称量空烧杯 E、向右盘加砝码并将游码移到所需位置
(3)若砝码和药品位置放颠倒(假设称量时未用烧杯),天平平衡时,实际称得碳酸钠的质量是 。
(4)下列操作使所配溶液浓度偏高的是 。
A、若称取28.6g Na2CO3·10H2O进行配制 B、称量时用了生锈的砝码
C、往容量瓶转移溶液时,有少量液体溅出 D、碳酸钠中含有不溶性杂质
E、未洗涤溶解Na2CO3的烧杯 F、定容时仰视刻度线
G、小烧杯洗净后未干燥即用来称量 H、容量瓶未干燥即用来配制溶液
16.某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据
|
硫酸铜溶液 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
加入的无水硫酸铜(g) |
2.5 |
4.0 |
6.0 |
8.0 |
|
析出的硫酸铜晶体(g) |
0.1 |
2.8 |
6.4 |
10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为
A.3.42g B.3.88g C.6.82g D.2.56g
第Ⅱ卷(非选择题 共86分)
 n=f(V)
n=f(V)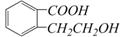 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: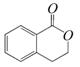 C.
C.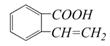
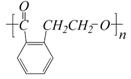 E.
E.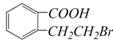
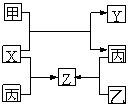 (10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
(10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系: