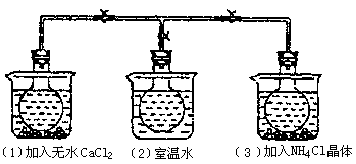
16.(12分)现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为amol ,Cu的物质的量分数为x;研成粉末后,全部投入含bmol 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)用微粒符号填写下列空白(列举出全部可能的情况)。
|
|
① |
② |
③ |
④ |
|
|
|
残留固体成份 |
|
|
|
|
|
|
|
溶液中的金属离子 |
|
|
|
|
|
|
(2)当溶液中金属离子只有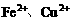 时,则b的取值范围是
时,则b的取值范围是
(用a、x表示) 。
(3)当x=0.5时,溶液中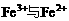 的物质的量相等时,在标准状况共产生672mL气体。求a、b的值
的物质的量相等时,在标准状况共产生672mL气体。求a、b的值
12.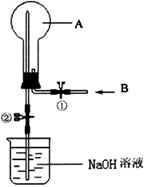 (10分) 如图所示,在一个烧瓶中充满气体A,打开①处的止水夹并向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。请按要求填表回答打开②处的止水夹前后烧瓶中所观察到的现象并按要求书写反应的化学方程式:
(10分) 如图所示,在一个烧瓶中充满气体A,打开①处的止水夹并向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。请按要求填表回答打开②处的止水夹前后烧瓶中所观察到的现象并按要求书写反应的化学方程式:
(1)
|
实验序号 |
气体A |
气体B |
现象 |
A与B反应的化学方程式 |
|
|
打开②处止水夹前 |
打开②处止水夹后 |
||||
|
① |
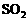 |
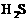 |
|
|
|
|
② |
 |
HCl |
|
|
|
|
③ |
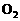 |
NO |
|
|
|
(2)分别完成以上三个实验后,烧瓶内剩余气体最多的是(填实验序号) 。
11.(9分)下图每一方框中的字母代表一种反应物或生成物:
|
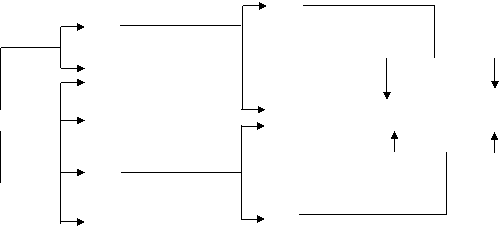
|

|
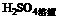
|
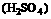 =1:1
=1:1

|
|
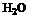
|
|
|
|
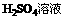
 n(B):n
n(B):n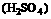 =1:2
=1:2
|
Y溶液
已知:常温下,C、D、F都是无色气体,其中C和D分子中的质子总数相等,C是一种可燃性气体,D能使湿润的红色石蕊试纸变蓝色,F能使澄清石灰水变浑浊;H是不溶于稀硝酸的白色沉淀。
(1)写出下列物质的化学式:C 、D 甲 、X 。
(2)写出NaOH与乙反应的有关化学方程式: 、
。
(3)写出G与Y反应后溶液为中性的离子方程式:
。
 在恒温恒容的容器中进行反应H2
2H; ΔH>0,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需反应的时间为
在恒温恒容的容器中进行反应H2
2H; ΔH>0,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需反应的时间为 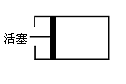 A.等于18s B.等于12s C.大于18s D.小于18s
A.等于18s B.等于12s C.大于18s D.小于18s 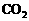 气体缓慢通入V LNaOH溶液中,结果
气体缓慢通入V LNaOH溶液中,结果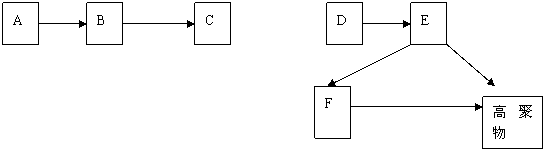 溴水 NaOH 新制Cu(OH)2
部分
溴水 NaOH 新制Cu(OH)2
部分 (过量) 水溶液△ △ 还原
(过量) 水溶液△ △ 还原

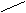
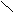 OH 自动失水
OH 自动失水
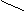
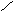 C
C=O+H2O
C
C=O+H2O OH
OH
 __________________________________
__________________。
__________________________________
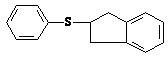
__________________。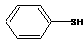 (3)茚与硫酚
反应生成
(3)茚与硫酚
反应生成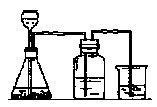 (8分)用50mL
NaOH溶液吸收CO2气体制备Na2CO3。为防止通入的CO2过量而生成NaHCO3,他设计了如下步骤:(i)用25mL
NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(ii)小心煮沸溶液1~2分钟;(iii)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(8分)用50mL
NaOH溶液吸收CO2气体制备Na2CO3。为防止通入的CO2过量而生成NaHCO3,他设计了如下步骤:(i)用25mL
NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(ii)小心煮沸溶液1~2分钟;(iii)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。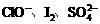 的氧化性由强到弱的顺序是
。
的氧化性由强到弱的顺序是
。