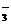|
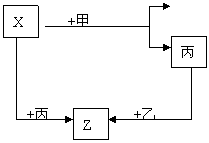
(1)若甲是具有氧化性的黄绿色气体单质,丙通常是暗红色的液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子。
①写出乙物质的化学式 ;
②写出X与过量的甲在水溶液中的离子反应过程式: 。
(2)若甲是具有还原性的金属单质,X、Y、Z中有一种是离子晶体,试推断:
①写出Y的电子式 ;
②写出X与甲反应的化学方程式,并标出电子转移的方向和数目:
30.(8分)A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种气体X,且X分子与B2A分子中的电子数相等。B与C可形成气体Y,且Y分子与最简式为BA的分子中的电子数相等。
请回答:
(1)写出元素的名称:A ,C 。
(2)完成下列反应的化学方程式。
①C2+(BA)n→A2
②C2+X(过量)→D
27.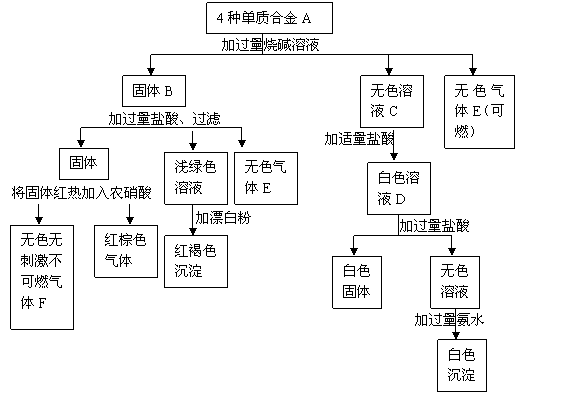 (1)(8分)固体混合物A由4种单质组成,经过一系列反应分别进入到沉淀或气体中。
(1)(8分)固体混合物A由4种单质组成,经过一系列反应分别进入到沉淀或气体中。
 |
|||||
 |
|||||
|
试回答:
①组成合金A的4种单质的元素符号是 (按元素原子序数由小到大顺序)。②写出由C转化为D的过程中所发生的离子反应方程式:
(2)(4分)常温下,将22.4gCu和Fe2O3的混合粉末加入到一定量1mol·L-1的H2SO4溶液中,粉末全部溶解,反应后溶液的体积为1L,并测得溶液中Fe2+浓度为0.1mol·
L-1。则原固体粉末中Cu的质量为 g。
26.(1)(4分)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应产物之一。
①该反应中氧化产物是 。
②若反应过程中转移了0.6mol电子,则生成水的质量是 g。
|
①在温度为t℃和压强为pPa的情况下,agA与bgB恰好完全反应,生成固体C和vL的D气体,计算生成的C的质量(m)。缺少的数据是 ,计算式为 。
②mg金属镁与v mL盐酸反应,计算生成的H2在标准状况下的体积[V(H2)]。缺少的数据是 ,计算式为 。
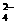 ,Br-,OH-,Ba2+
,Br-,OH-,Ba2+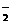 ,CO
,CO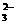 ,SO
,SO