网址:http://m.1010jiajiao.com/timu3_id_363059[举报]
A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为 ?? ,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于 ?? ,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是 ?? 。
(2)当n=2时,B原子的结构示意图为 ?? ,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为 ?? ,该晶体中最小的环共有 ?? 个微粒构成,微粒间的作用力是 ?? 。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是 ?? ,A、B、C、D四种元素的第一电离能由大到小的顺序是
?? (用元素符号表示)。
B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
 (1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
| 编号 | I | II | III | IV | V |
| V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
| V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
| 现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭 不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为 ?? 。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答: ?? (填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答: ?? (“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
| a | 在烧瓶中加热适量浓HNO3 4HNO3 △ 4NO2↑+O2↑+2H2O↑ | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
| b | 加热AgNO3固体 2AgNO3 △ 2NO2↑+O2↑+2Ag | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
| c | 加热Cu(NO3)2固体 2Cu(NO3)2 △ 4NO2↑+O2↑+2CuO | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a. ?? ,原因是 ?? 。
b. ?? ,原因是 ?? 。
c. ?? ,原因是 ?? 。
查看习题详情和答案>>(每空2分,共12分)某化学研究性学习小组探讨Fe3+和SO32―之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应的离子方程式为 ;
乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32―+6H2O=2Fe(OH)3(胶体)+3H2SO3;
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是 。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是: ;
②实验③中溶液变成血红色的离子方程式为 。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-小外,还有 。
查看习题详情和答案>>(本小题共12分 )某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).

请按要求填空:
(1)利用B装置可制取的气体有______________________(写出两种即可).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实
验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
(共12分)某同学利用以下装置制备氨气并探究氨气的还原性。
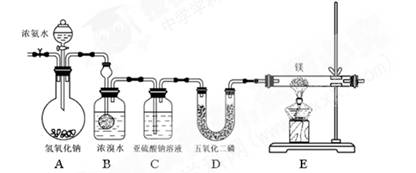
实验步骤及现象:①连接仪器并检验装置气密性②通入惰性气体(不与镁反应),排出装置中的空气③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡④点燃酒精灯,观察E中固体变成了黄绿色。
查阅资料:氮化镁是黄绿色固体,遇水剧烈反应生成两种碱。
请回答下列问题:
(1)A中氢氧化钠的作用为 (用简要的语言和方程式来说明)
(2)写出B处反应的化学方程式
(3)亚硫酸钠的作用
(4)此装置有不足之处,请说明
(5)某同学要继续探究E中固体成分。将E中的固体放入稀盐酸中,观察到固体溶解并产生气泡,写出此过程中反应的化学方程式
查看习题详情和答案>>