0 36110 36118 36124 36128 36134 36136 36140 36146 36148 36154 36160 36164 36166 36170 36176 36178 36184 36188 36190 36194 36196 36200 36202 36204 36205 36206 36208 36209 36210 36212 36214 36218 36220 36224 36226 36230 36236 36238 36244 36248 36250 36254 36260 36266 36268 36274 36278 36280 36286 36290 36296 36304 447348
 化 学
化 学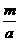 L B.
L B.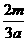 L C.
L C.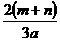 L D.
L D.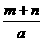 L
L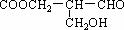 有光学活性,它分别发生下列反应:①与甲酸发生酯化反应,②与NaOH水溶液共热,③与银氨溶液作用,④在催化剂存在下与H2作用后,生成的有机物无光学活性的是:
有光学活性,它分别发生下列反应:①与甲酸发生酯化反应,②与NaOH水溶液共热,③与银氨溶液作用,④在催化剂存在下与H2作用后,生成的有机物无光学活性的是: