13、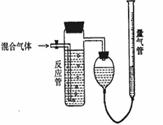 (10分)工业上测定SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O==H2SO4+2HI
(10分)工业上测定SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O==H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写混合气体的分子式)
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)
(3)反应管内的碘的淀粉溶液也可以用 代替 (填物质的名称)
(4)若碘溶液体积为Va mL,浓度为Cmol/L。N2与O2的体积为Vb mL(已折算成标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为 。(填写下列仪器似的编号)
a烧杯 b试管 c广口瓶 d容量瓶 e量筒 f单孔塞 g双空塞
14、(14分)SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下实验装置:
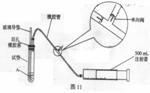
(1)检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后
(填写操作方法)时,将会看到 (填写实验现象),则证明该装置的气密性良好。
(2)向试管中加入0.0005mol·L-1的碘水1.0mL,用适量的蒸馏水稀释后再加入2-3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由 色变为 色时反应恰好完全进行,此时停止抽气,该反应的化学方程式为
。
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
|
浓度限值/mg·m-3 |
||
|
一级标准 |
二级标准 |
三级标准 |
|
0.15 |
0.50 |
0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A,在同一地点、同时测量空气中SO2的含量。当反应恰好完全进行,记录抽气次数如下(假设每次抽气500mL)。请将下表填写完整(计算时保留2倍有效数字):
|
分组 |
第一小组 |
第二小组 |
|
抽气次数 |
120 |
140 |
|
SO2含量/mg·m-3 |
|
|
判断该地点的空气中SO2的含量属于 (填数字)级标准, (“第一”或“第二”)小组的测定结果正确,另一小组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题)
。
10、(10分)某工厂废液经测定得知含有乙醇、甲醇、乙酸和乙酸乙酯。现欲从废液中回收甲醇、乙醇和乙酸,根据各物质的性质 (见下表) ,补充下列实验步骤,并回答有关问题:
|
物质 |
甲醇 |
乙酸乙酯 |
乙醇 |
乙酸 |
|
沸点/℃ |
65 |
77 |
78 |
118 |
可供选择的实验用品:250 mL 蒸馏烧瓶,400 mL 烧杯,250 mL 烧杯,温度计,冷凝器接受器,玻璃棒以及中学化学实验的常用仪器。1摩尔/LNaOH 溶液, 18.4 mol/LH2SO4 溶液,蒸馏水和冰
(1)补充下列实验步骤,直至达到实验目的。
第一步:组装蒸馏装置,检查其气密性;
第二步:取100 mL 废液注入250 mL 蒸馏烧瓶中,滴入1 mol/LNaOH溶液,调整废液的pH=10 ;
第三步:___________________________ 。
第四步:_______________________ 得甲醇。
第五步:__________________________得乙醇。
第六步:__________________________
得乙酸。
(2)滴入 1 mol/LNaOH 溶液,使溶液的 pH=10 的目的是______________
。
( 3 )使用 18.4 mol/LH2SO4 目的是(用化学方程式表示)_____________________ _。
6、学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上
喷洒某种试剂,挂在铁架台上。另取一只盛有某种
 液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是
(
)
液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是
(
)
|
|
A |
B |
C |
D |
|
纸蝴蝶上的喷洒液 |
石蕊 |
酚酞 |
酚酞 |
石蕊 |
|
小烧坏中的溶液 |
浓盐酸 |
浓氨水 |
氢氧化钠溶液 |
浓硫酸 |
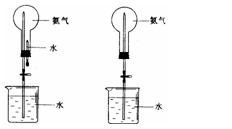 (15分)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(15分)制取氨气并完成喷泉实验(图中夹持装置均已略去)。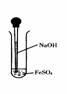 (14分)实验室用如图所示方法制Fe(OH)2,但一般看不到白色沉淀,而是灰绿色转为红褐色的沉淀,请回答:
(14分)实验室用如图所示方法制Fe(OH)2,但一般看不到白色沉淀,而是灰绿色转为红褐色的沉淀,请回答: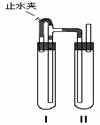 方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。 (5分)以下气体:①H2 ②Cl2 ③CH4 ④NO ⑤SO2 ,(烧瓶的位置不能移动)
(5分)以下气体:①H2 ②Cl2 ③CH4 ④NO ⑤SO2 ,(烧瓶的位置不能移动)