14.(1998年全国,22)将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是( )
|
|
NaOH的质量分数 |
阳极析出物的质量/g |
阴极析出物的质量/g |
|
A |
0.062(6.2%) |
19 |
152 |
|
B |
0.062(6.2%) |
152 |
19 |
|
C |
0.042(4.2%) |
1.2 |
9.4 |
|
D |
0.042(4.2%) |
9.4 |
1.2 |
解析:电解NaOH溶液时电极反应为:
阳极:4OH--4e-====2H2O+O2↑
阴极:4H++4e-====2H2↑,即电解水。
由此可知电解后NaOH浓度增大,阳极产物(O2)质量大于阴极产物(H2)质量。
 H2+NiO(OH)
H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )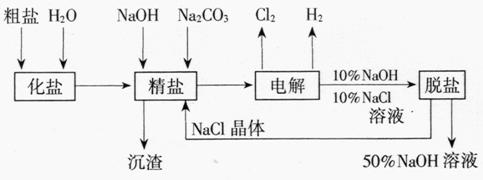
 ,该钡试剂可以
,该钡试剂可以 =====CaCO3↓
=====CaCO3↓ Q+NaCl
(2)Q+H2O
Q+NaCl
(2)Q+H2O X+H2
X+H2 Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )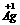 2O+
2O+ +H2O 2
+H2O 2 +
+ (OH)2原电池中失去电子的物质是负极,所以选D。
(OH)2原电池中失去电子的物质是负极,所以选D。