摘要:12.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图 14-4如下 图14-4 依据上图.完成下列填空: (1)在电解过程中.与电源正极相连的电极上所发生反应的化学方程式为 .与电源负极相连的电极附近.溶液pH (选填“不变 “升高 或“下降 ). (2)工业食盐含Ca2+.Mg2+等杂质.精制过程发生反应的离子方程式为 . . (3)如果粗盐中SO2-4含量较高.必须添加钡试剂除去SO.该钡试剂可以 是 . a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2 (4)为有效除去Ca2+.Mg2+.SO.加入试剂的合理顺序为 . a.先加NaOH,后加Na2CO3.再加钡试剂 b.先加NaOH.后加钡试剂.再加Na2CO3 c.先加钡试剂.后加NaOH.再加Na2CO3 (5)脱盐工序中利用NaOH和NaCl在溶解度上的差异.通过 .冷却. 除去NaCl (6)在隔膜法电解食盐水时.电解槽分隔为阳极区和阴极区.防止Cl2与NaOH反应,采用无隔膜电解冷的食盐水时.Cl2与NaOH充分接触.产物仅是NaClO和H2.相应的化学方程式为 . 解析:(1)与电源负极相连的电极.其反应为:2H++2e-===H2↑.促使H2O===H++ OH-向右移动.产生大量OH-.pH升高. (3)溶液中已有OH-.Cl-.如果加入Ba(NO3)2.即掺入了新的杂质NO-3离子. (4)欲有效除去三种离子.所加的三种试剂应过量.过量的Ba2+必须用CO2-3除去.所以加钡试剂必须在加Na2CO3之前. 答案:(1)2Cl--2e-====Cl2,升高 (2)Ca2++CO=====CaCO3↓ Mg2++2OH-====Mg(OH)2↓ b.c (5)蒸发,过滤 (6)NaCl+H2O=====NaClO+H2↑ 或2NaCl+2H2O=======H2↑+Cl2↑+2NaOH Cl2+2NaOH====NaCl+NaClO+H2O
网址:http://m.1010jiajiao.com/timu3_id_36157[举报]
(1998年上海,31)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图14-4如下
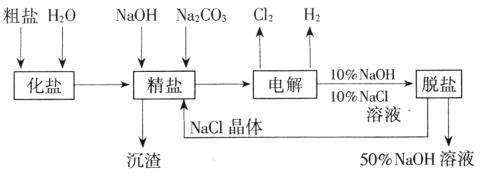
图14-4
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是 (选填a,b,c多选扣分)。
,该钡试剂可以是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
查看习题详情和答案>>