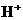24.(11分)准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20 mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
|
|
NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
第一次 |
0.01Ml |
18.60mL |
|
第二次 |
0.20Ml |
18.00mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为______________mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中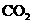 反应产生少量
反应产生少量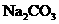 ),测出的盐酸浓度__________(填“偏高”、“偏低”或“不变”)。
),测出的盐酸浓度__________(填“偏高”、“偏低”或“不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是____________(填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?____________(填“是”或“否”)
22.(15分)实验室中用浓盐酸与 反应制
反应制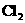 ,再用
,再用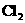 和
和 反应制少量漂白粉。已知
反应制少量漂白粉。已知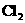 与
与 制漂白粉的反应是放热反应,温度稍高即发生副反应:6
制漂白粉的反应是放热反应,温度稍高即发生副反应:6 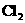 +6
+6 =
= +5Ca
+5Ca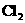 +6
+6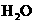 。现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
。现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
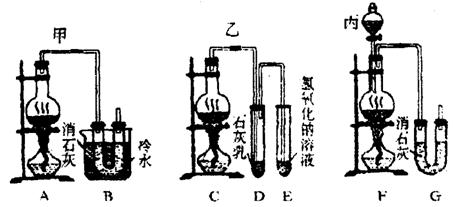
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内。
a.不易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.容易污染环境 f.可防止污染环境
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
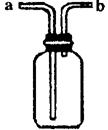
(2)请从甲、乙、丙三套装置中,选择合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,其连接顺序(按气流从左到右方向)为:_________;在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,并说明原因:______________________________________________________________________________________________________________________________________________________________________________________________。
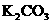 样品中含有
样品中含有 和
和 三种杂质中的一种或两种,现将13.8g样品中加入足量水,样品全部溶解,再加入过量的
三种杂质中的一种或两种,现将13.8g样品中加入足量水,样品全部溶解,再加入过量的 溶液,得到9g沉淀。对样品所含杂质的正确判断是 ( )
溶液,得到9g沉淀。对样品所含杂质的正确判断是 ( )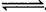 xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后C的体积分数仍为W%,则x值为 ( )
xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后C的体积分数仍为W%,则x值为 ( )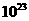 B.n×6.02×
B.n×6.02×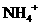 )=c(
)=c( )
)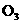 +
+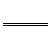 2KOH+
2KOH+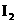 +
+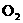
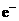
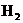 +
+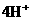 +4
+4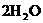 +4
+4
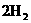 -4
-4