22.(11分)某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用图3所示装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
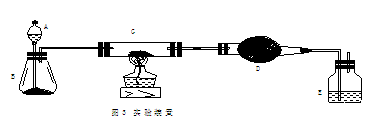
(1)实验目的:________▲_________。
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)。
表1 实验步骤,现象及方程
|
实验步骤 |
实验现象 |
有关化学方程式 |
||||
 在G中加入样品粉末Wg,D中装入药品后并称量为 在G中加入样品粉末Wg,D中装入药品后并称量为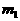 g,连接好仪器后,检查气密性 g,连接好仪器后,检查气密性 |
 |
|
||||
|
打开A的活塞,慢慢滴加溶液 |
▲ |
▲ |
||||
|
对G进行加热,当G中药品充分反应后,关闭A的活塞,停止加热 |
|
|
||||
 冷却后,称量D的质量为 冷却后,称量D的质量为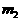 g g |
|
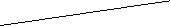 |
(4)计算:样品中铜的质量分数=_____▲ ____(用含W,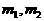 的代数式表示);
的代数式表示);
(5)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与G之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是____▲______。在B与G之间加入的装置可以是______▲_______,其中盛放的药品是_____▲_______。
21.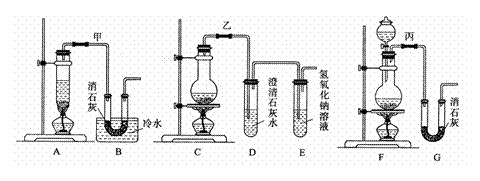 (11分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2
(11分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。现有3个同学分别设计的3套实验装置如下图:
(1)写出制取氯气的化学方程式 _▲ ;
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格中。
a.不容易控制反应速率; b.容易控制反应速率; c.有副反应发生;
d.可防止副反应发生; e.污染环境; f.可防止污染环境
|
|
优
点 |
缺 点 |
|
甲装置 |
▲ |
▲ |
|
乙装置 |
▲ |
▲ |
|
丙装置 |
▲ |
▲ |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分连接顺序是 _▲ (按气流流动的方向)。该组合中还缺少的装置是 _▲ ,
原因是 _▲ ;
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯
酸钙的物质的量最多不超过 ▲ mol。
 (A)61.71%
(B)38.24%
(C)60%
(D)40%
(A)61.71%
(B)38.24%
(C)60%
(D)40% (C)2-乙基丁烷
(D)2,2,3-三甲基丁烷
(C)2-乙基丁烷
(D)2,2,3-三甲基丁烷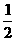 O2(g) == H2O(l );△H = -285.8kJ/ mol
O2(g) == H2O(l );△H = -285.8kJ/ mol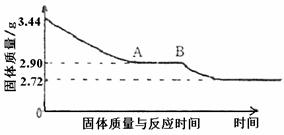 24.(6分)某化学小组为了测定石膏(CaSO4·xH2O),即测定x值。做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如下图所示。数据表明当固体的质量为2.72g后不再改变。
24.(6分)某化学小组为了测定石膏(CaSO4·xH2O),即测定x值。做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如下图所示。数据表明当固体的质量为2.72g后不再改变。