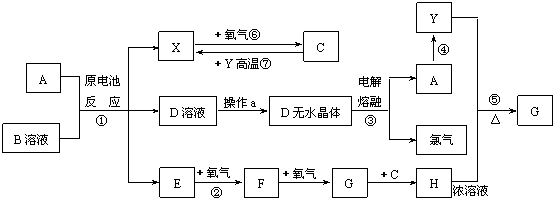
24.有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙三种化合物,各化合物中原子个数比关系如下表:
|
|
甲 |
乙 |
丙 |
|
化合物中各元素原子个数比 |
A∶C=1∶1 |
D∶E=1∶3 |
B∶E=1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)写出A、B、C、D的元素名称:A、_________ B、_________ C、_________D、_________
(2)向甲的水溶液中加入MnO2,反应的化学方程式: 。
(3)乙的水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式是 。
(4)向30 mL 1 mol·L-1 KI溶液中依次注入下列试剂:①1 mL 5 mol·L-1盐酸
②0.5 mol·L-1 30%甲溶液 ③1 mL丙,经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是______________。
五 计算
23.通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
P-H |
Si-Cl |
H-H |
P-P |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
326 |
360 |
436 |
197 |
176 |
347 |
请回答下列问题:
⑴ 比较下列两组物质的熔点高低 (填>或<)
SiC______ Si; Si(晶体)______ P(白磷) ;PH3 HF; PCl5 SiCl4
(2) PH3在加热条件下分解生成白磷和氢气,4 PH3(g) === 6H2(g)+P4(s);
该反应的反应热△H = ___________ KJ/mol
(3)液态有机物2.3g和一定量的氧气混合点燃,恰好完全燃烧,生成2.7gH2O和2.24LCO2(标准状况)并放出68.35kJ的能量,则该反应的热化学方程式为:
(4)反应热也可以用实验方法测定。如用n mL0.50mol/L的硫酸与n mL1.10mol/L的NaOH
溶液混合,若酸碱溶液密度均近似为1g/mL,溶液的比热容为4.18J/(g·℃)
反应前硫酸温度为t1,氢氧化钠溶液温度为t2,反应后混合溶液温度为t3,则水的中和
热的计算表达式为△H=
18、纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体,下列区分这两种物质的
说法正确的是 ( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,使火焰颜色发生明显变化的是小苏打
C.用两只小玻璃杯,分别加入少量的两种样品,再加入等浓度的食醋,产生气泡速率较快的是小苏打
D.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
华罗庚中学高三化学答题卷 姓名 学号
第II卷(78分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
|
|
|
|
|
|
|
|
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
|
|
|
|
|
|
|
|
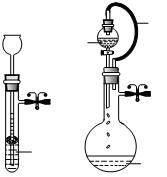 (二)根据右图描述回答下列问题:①关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。
(二)根据右图描述回答下列问题:①关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3mol/L和0.08mol/L,则下列判断不合理的是
( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3mol/L和0.08mol/L,则下列判断不合理的是
( )