2. 在一定条件下,用CO和H2为原料合成甲醇,其反应方程式为:CO +2H2 CH3OH(g)。当原料气中H2和CO的比例不同时,对CO的转化率以及平衡混合物中CH3OH的体积分数都有影响。
在一定条件下,用CO和H2为原料合成甲醇,其反应方程式为:CO +2H2 CH3OH(g)。当原料气中H2和CO的比例不同时,对CO的转化率以及平衡混合物中CH3OH的体积分数都有影响。
(1)以m表示H2和CO的物质的量之比(即H2:CO= m:1),α表示CO的平衡转化率,x为平衡中CH3OH的体积分数,则x =_______________
(2)下表列出m = 1,2,3,4时部分实验数据,据此数据得出反应物的比例对CO转化率(α)以及平衡混合物中CH3OH的体积分数(x)产生影响的结论,并在实际生产中选择最佳的反应配比。
|
m |
1 |
2 |
3 |
4 |
|
α |
0.25 |
0.45 |
0.56 |
0.62 |
|
x |
16.7 % |
21.5 % |
19.4 % |
16.4 % |
①所得结论是___________________________________;
②反应物的最佳配比是__________。
1.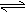 反应CaCO3(s) CaO(s)
+ CO2↑在不同温度下CO2的平衡压强如下表:
反应CaCO3(s) CaO(s)
+ CO2↑在不同温度下CO2的平衡压强如下表:
|
温度/℃ |
550 |
650 |
750 |
850 |
897 |
|
压强/Pa |
5.32×101 |
9.17×102 |
8.37×103 |
4.94×104 |
1.01×105 |
(1)若升高原CaCO3分解平衡体系的压强,同时给反应容器加压,则原平衡( )
A.向左移动 B.向右移动 C.不移动 D.无法确定平衡移动
(2)在一个与外界不能进行热交换的密闭容器中,足量的CaCO3在850℃时建立了分解平衡。若将该容器的容积扩大为原来的2倍,当重新达到平衡时,容器内的温度将________,CO2的平衡压强将______4.94×104(>,<,=),理由是____________________________。
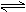 C(g)达到平衡时,C的体积分数为40%。试回答有关问题:
C(g)达到平衡时,C的体积分数为40%。试回答有关问题: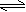 下动态平衡的缘故: O2 + O O3
下动态平衡的缘故: O2 + O O3  对于反应aA + bB c C
+ d D,瞬时速率V (正)= k1C(A)a .C(B)b。将4 mol SO2和2mol O2充入容积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%,则:
对于反应aA + bB c C
+ d D,瞬时速率V (正)= k1C(A)a .C(B)b。将4 mol SO2和2mol O2充入容积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%,则: