1.下列事实中能应用平衡移动原理解释的是:( )
A.H2、I2、HI平衡混合气加压后颜色变深 B.加入催化剂有利于氨氧化的反应
C.500℃左右比室温更有利于合成氨的反应 D.高压有利于合成氨的反应
1.合成氨条件的选择
合成氨反应式____________________;
反应特点__________________________________________;
速率方程_______________________________
|
|
生产要求 |
综合选择 |
|
|
生成NH3速率大 |
NH3的平衡浓度大 |
||
|
各物质浓度 |
|
|
|
|
温度 |
|
|
|
|
压强 |
|
|
|
|
催化剂 |
|
|
|
※2. 合成氨工业
(1)原理__________________________
(2)生产过程包括造气、净化、合成氨三部分。
① 造气:N2来自于___________________,H2__________________________。
② 净化的目的____________________________________;
③ 合成氨包括_____________、_______________、________________等。
学习导航
 例1.可逆反应3H2(g) + N2(g) 2NH3(g);△H<0,达到平衡后,为了使H2 的转化率增大,下列选项中采用的三种方法都正确的是( )
例1.可逆反应3H2(g) + N2(g) 2NH3(g);△H<0,达到平衡后,为了使H2 的转化率增大,下列选项中采用的三种方法都正确的是( )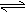 2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。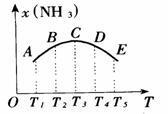 (1)A、B、C、D、E五点中,尚未达到
(1)A、B、C、D、E五点中,尚未达到