14.中药秦皮中含有的七叶内酯属于香豆素类,具有显著的消炎作用,是抗痢疾杆菌的有效成分。其结构简式如下:
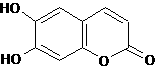
(1)七叶内酯的含氧官能团的名称为 。
(2)七叶内酯可以发生的反应类型有 (填序号)。
a.加成反应 b.取代反应 c.消去反应
(3)香豆素类物质常被看做是肉桂酸的衍生物。工业上可用物质A制备肉桂酸和肉桂醇。反应关系如下:
|
|
|


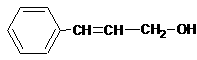
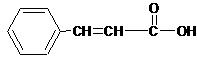
肉桂醇 肉桂酸
A的结构简式为 。
(4)七叶内酯与足量氢氧化钠稀溶液充分反应。化学方程式为
。
11. 在400 ℃、101 kPa时,NO2(g)+CO(g) NO(g) + CO2(g)反应过程的能量变化如下图所示。
在400 ℃、101 kPa时,NO2(g)+CO(g) NO(g) + CO2(g)反应过程的能量变化如下图所示。
|
|
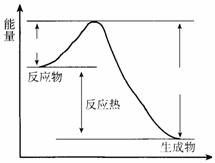
反应过程
(1)该反应是 (填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为 。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的
是 (填序号)。
|
a.浓度 |
b.压强 |
|
c.温度 |
d.催化剂 |
 C.碳酸铵受热分解 D.CO点燃时生成CO2
C.碳酸铵受热分解 D.CO点燃时生成CO2 2C D.A+3B
2C D.A+3B 25℃时, 已知反应:CO2(g) + H2(g) CO (g) + H2O
(g) △H = + 41 kJ/mol。回答下列问题:
25℃时, 已知反应:CO2(g) + H2(g) CO (g) + H2O
(g) △H = + 41 kJ/mol。回答下列问题: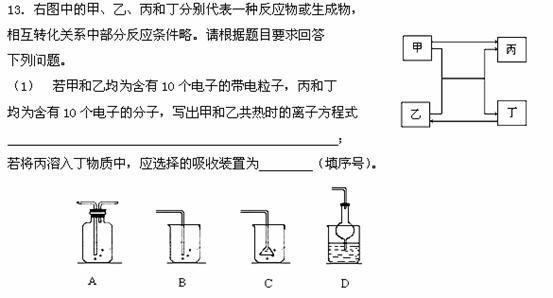
 (5)若甲和丁为非金属单质,乙和丁为非金属氧化物,则甲和丁可能为
、
(5)若甲和丁为非金属单质,乙和丁为非金属氧化物,则甲和丁可能为
、
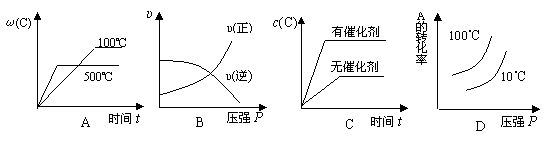
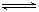 2C(g) △H<0,下列各图正确的是
2C(g) △H<0,下列各图正确的是