|
|
离子键 |
共价键 |
|
定义 |
离子键: |
|
|
共价键: |
||
|
形成过程 |
得失电子 |
共用电子对 |
|
成键微粒 |
|
|
|
成键元素 |
|
|
|
实例 |
|
|
|
表示方法 (任举一例) |
|
|
分子间作用力:定义
分子间作用力仅存在于由 构成的物质,它的作用力比化学键 (“强”或“弱”),分子间作用力是影响物质的 和 的重要因素之一。
能用电子式、结构式、结构简式表示常见微粒或物质
|
元素(原子)符号 |
Na |
Mg |
Al |
H |
O |
S |
F |
Cl |
|
原子电子式 |
|
|
|
|
|
|
|
|
|
离子符号 |
|
|
|
|
|
|
|
|
|
离子电子式 |
|
|
|
|
|
|
|
|
用电子式来表示以离子键结合的物质,
AB型:NaCl MgO (KCl CaO等)
A2B型:Na2O K2S (Na2S K2O等)
AB2型:MgCl2 CaCl2 (MgBr2 CaBr2等)
拓展: Na2O2 NaOH NH4Cl
用电子式、结构式来表示以共价键相结合的物质
单质 :H2 N2 (F2 Cl2等)
化合物:HCl H2O NH3 CH4
拓展: CO2 H2O2 CCl4
(三)A. 元素的金属性和非金属性强弱的比较(重点、难点)
|
金属性越强 |
非金属性越强 |
|
①原子半径越 ; |
①原子半径越 ; |
|
②单质的 性越强; |
②单质的 性越强; |
|
③与水或酸反应生成氢气越 ; |
③与氢气反应越 ;生成氢化物越 ; |
|
④最高价氧化物对应水化物 性越强。 |
④最高价氧化物对应水化物 性越强。 |
同周期与同主族的变化规律
|
|
|
同周期 (从左到右) |
同主族 (从上到下) |
|
结构 |
核电荷数 |
|
|
|
电子层数 |
|
|
|
|
最外层电子数 |
|
|
|
|
原子半径 |
|
|
|
|
性质 |
元素原子失电子能力 |
|
|
|
元素原子得电子能力 |
|
|
|
|
金属性 |
|
|
|
|
非金属性 |
|
|
|
|
金属单质与水或酸置换出H2 |
|
|
|
|
最高价水化物的酸、碱性 |
|
|
|
|
气态氢化物的稳定性 |
|
|
以第三周期、第IA 、ⅦA族为例:
第三周期:原子半径由大到小的顺序为
金属单质与水或酸置换出氢由易到难的顺序为 > >
最高价氧化物的水化物碱性由强到弱的顺序为 > >
金属性: > >
非金属单质与氢气反应由易到难的顺序为 > > >
气态氢化物的稳定性顺序为 > > >
最高价氧化物的水化物酸性由强到弱的顺序为 > > >
非金属性: > > >
第IA族:原子半径由小到大的顺序为
金属单质与水或酸置换出氢由易到难的顺序为 > > > >
最高价氧化物的水化物碱性由强到弱的顺序为 > > > >
金属性: > > > >
第ⅦA族:原子半径由小到大的顺序为
非金属单质与氢气反应由易到难的顺序为 > > > >
气态氢化物的稳定性顺序为 > > > >
最高价氧化物的水化物酸性由强到弱的顺序为 > >
非金属性: > > > >
(四)、画出1-18号元素的原子结构示意图
|
1 |
|
2 |
|||||
|
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
 三短(第 、 、 周期)
三短(第 、 、 周期) 七主(A)(第
、 、 、 、 、 、 族)
七主(A)(第
、 、 、 、 、 、 族)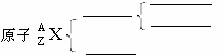
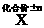
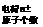 :
: