网址:http://m.1010jiajiao.com/timu3_id_323306[举报]
合成氨反应(N2+3H2 2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。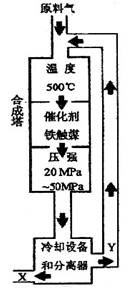
30. X的化学式为 ;X的状态为_______态。
31. 据右图分析,下列说法正确的是 (填写编号)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
32. 常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水的离子积常数的数值是_______________________;
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,
溶液中离子浓度由大到小依次为 。
合成氨反应(N2+3H2  2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。

30. X的化学式为 ;X的状态为_______态。
31. 据右图分析,下列说法正确的是 (填写编号)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
32. 常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水的离子积常数的数值是_______________________;
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,
溶液中离子浓度由大到小依次为 。
查看习题详情和答案>>
 2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。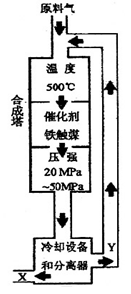
30. X的化学式为 ;X的状态为_______态。
31. 据右图分析,下列说法正确的是 (填写编号)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
32. 常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水的离子积常数的数值是_______________________;
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,
溶液中离子浓度由大到小依次为 。
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入1 mol N2和3 mol H2,平衡后NH3的体积分数为a;若在恒温、恒容条件下向平衡体系中通入1 mol N2和3 mol H2,平衡后NH3的体积分数为b,则a________b(填“大于”、“等于”、“小于”).
2NH3(g),若在恒温、恒压条件下向平衡体系中通入1 mol N2和3 mol H2,平衡后NH3的体积分数为a;若在恒温、恒容条件下向平衡体系中通入1 mol N2和3 mol H2,平衡后NH3的体积分数为b,则a________b(填“大于”、“等于”、“小于”).
(2)有一带有刻度的容器被一种特殊的隔膜分成左右两部分,如下图所示:
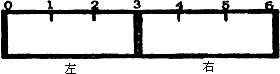
若该隔膜为阳离子交换膜(只允许阳离子自由通过),且将该膜固定在3处,左边充满滴有少量KSCN溶液的FeCl2溶液,右边充满酸性KMnO4溶液,一段时间后可观察到的现象:左________,右________.(从下列选项中选择)
A.无观显现象
B.溶液变为红色
C.溶液红色变浅
D.有红褐色沉淀生成
试写出右边产生该现象的离子方程式________.
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图.

①写出工业上合成氨的化学方程式
| ||
| 高温高压 |
| ||
| 高温高压 |
②图A中氨气的体积分数为15.00%时,H2的转化率=
③图B中T=500°C,温度为4500C对应的曲线是
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O
 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
前5min平均反应速率v(CH4)=
②反应在7~10min之间,CO的物质的量减少的原因可能是
a?减少CH4 b?降低温度c?增大压强d?充入H2
③若保持温度不变,向1L容器中起始充入0.15mol CH4.0.45mol H2O.