18. (10分)甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l) HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
|
组分 |
HCOOCH3 |
H2O |
HCOOH |
CH3OH |
|
物质的量/mol |
1.00 |
1.99 |
0.01 |
0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

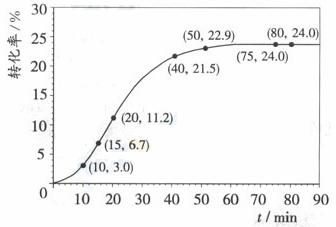
(1) 请计算15-20min范围内甲酸甲酯的减少量为
mol,甲酸甲酯的平均反应速率为 (不要求写出计算过程)。
请计算15-20min范围内甲酸甲酯的减少量为
mol,甲酸甲酯的平均反应速率为 (不要求写出计算过程)。
(2)向平衡后的溶液中加入一定量的水平衡 移动。
(3)上述反应的平衡常数表达式为: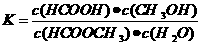 ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。(画出大体走势即可)
17. (18分)科学家一直致力于“人工固氮”的新方法研究,目前合成氨工业的核心反应是:
(18分)科学家一直致力于“人工固氮”的新方法研究,目前合成氨工业的核心反应是:
 N2 (g)
+ 3H2 (g)
N2 (g)
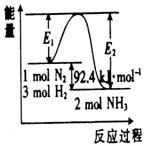
+ 3H2 (g)  2NH3(g);△H=Q kJ·mol-1。反应过程中能量变化如图所示,请回答下列问题:
2NH3(g);△H=Q kJ·mol-1。反应过程中能量变化如图所示,请回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化:
E1 ,E2 ,Q 。(填“增大”“减小”“不变”)
(2)在5000C、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量 (填 “大于”、“小于”或“等于”)46.2kJ。
(3)在恒温恒压下,欲提高合成氨反应中H2的转化率,下列措施可行的是 (填字母)
A. 向容器中按比例再充入原料气 B. 向容器中再充入一定量H2
C. 使用新型催化剂 D. 分离出氨
 (4)根据最新“人工固氮”的研究报道,在常温常压、光照条件下,N2在催化剂(掺有少量的Fe2O3的TiO2)表面与水发生反应:N2 (g)
+ 3H2O(l)
(4)根据最新“人工固氮”的研究报道,在常温常压、光照条件下,N2在催化剂(掺有少量的Fe2O3的TiO2)表面与水发生反应:N2 (g)
+ 3H2O(l)  2NH3(g) +
2NH3(g) +
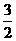 O2
(g);△H= a kJ·mol-1。进一步研究NH3生成量与温度的关系,在常压下达到平衡时测得部分实验数据如下表:
O2
(g);△H= a kJ·mol-1。进一步研究NH3生成量与温度的关系,在常压下达到平衡时测得部分实验数据如下表:
|
T/K |
298 |
313 |
323 |
|
NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
①此合成反应中的a (填“>”、“<”或“=”)0。
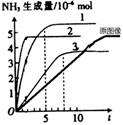
②若在常温常压下改变一个实验条件(温度、压强、催化剂)得到NH3生成量随时间变化的曲线1、2、3(如图所示),则曲线1、2、3所对应的实验条件改变分别是:1. ,2. ,3. 。
 A
B
C
D
A
B
C
D H1=1175.7
kJ·mol-1
H1=1175.7
kJ·mol-1 aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是 和OH-
和OH-