20.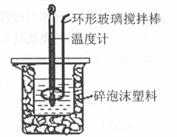 (10分)用50 mL 0.50mol·L-1盐酸与50 mL
0.55 mol·L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热。
(10分)用50 mL 0.50mol·L-1盐酸与50 mL
0.55 mol·L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热。
|
|
起始温度t1/℃ |
终止温度t2/℃ |
温度差 (t2-t1)/℃ |
||
 |
 |
平均值 |
|||
|
1 |
25.5 |
25.0 |
25.25 |
28.5 |
3.25 |
|
2 |
24.5 |
24.2 |
24.45 |
27.6 |
3.15 |
|
3 |
25.0 |
24.5 |
24.75 |
26.5 |
1.75 |
(1)在该实验中,量取50 mL盐酸或NaOH溶液,需要用到的玻璃仪器是 ;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是 ;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指 温度;
(4)计算该实验发生中和反应时放出的热量为 kJ(保留两位小数)[中和后生成的溶液的比热容c=4.18 J·(g·℃)-1,稀溶液的密度都为1 g·cm-3];
(5)如果用50 mL 0.55 mol·L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其放出的能量将偏小,其原因是 。
16.根据表中烃的含氧衍生物分子式排列规律,空格中烃的含氧衍生物的有关判断正确的是
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
CH2O2 |
C2H4O |
C3H6O2 |
C4H8O |
|
C6H12O |
C7H14O2 |
C8H16O |
A.能与NaHCO3反应的同分异构体有3种 B.该物质肯定能发生加成反应和取代反应
C.1mol符合该分子式的一种有机物与足量Na反应能生成1mol H2,则该物质中一定存在一条碳碳双键
D.该物质与丁烷以任意物质的量比混合时,只要混合物的物质的量一定,消耗的氧气量也一定
第Ⅱ卷(共6题,52分)
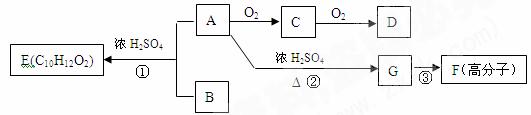

 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol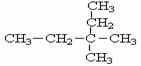
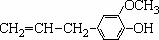 ,该物质不应有的化学性质是:( )
,该物质不应有的化学性质是:( )