31. (8分)
(8分)
⑴右图是A与D形成的一种化合物的晶体结构示意图,其中
的虚线表示 。
E与D按原子个数比1∶1形成的化合物的电子式为
____________ ____。
⑵化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-----D |
F------F |
B------B |
F------B |
C-------D |
D-------D |
|
键能(KJ·
mol-1) |
460 |
176 |
347.7 |
347 |
745 |
479.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用abc表示): ___ ____。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算1molF单质晶体完全燃烧的反应热:ΔH= 。
27.(4分)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,
AG=lg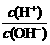 。
。
|
34.(20分)某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
浓度(mol/L) |
时间(min) |
|||||||
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
|
1 |
温 度 |
8000C |
1.0 |
0.80 |
O.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8000C |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
|
3 |
8000C |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
|
4 |
8200C |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在0至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应在 20分钟内就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,且c3=_______mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
理由是____________________________________________
(5) 800℃时,反应2A  B+D的平衡常数=
, 其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L,
B+D的平衡常数=
, 其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L,
B的转化率= .
注意:非选择题应在答卷上相应的区域作答。
 |
|||
|
|||
高二化学试题(选修四)[答卷]
命题:郑元庆
|
班级 |
|
|
第I卷 选择题(70分)
|
一、单项选择题(每小题2分,共30分) |
|
姓 名 |
|
|
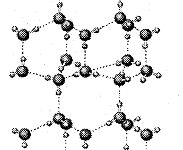
31.(8分)核电荷数依次增大的A、B、C、D、E、F六种短周期元素,已知:A与E、B与F分别同主族;A、E都能与D按原子个数比1∶1或2∶1形成化合物;B、C分别都能与D按原子个数比1∶1或l∶2形成气态化合物。
 ⑴右图是A与D形成的一种化合物的晶体结构示意图,其中
⑴右图是A与D形成的一种化合物的晶体结构示意图,其中
的虚线表示 。
E与D按原子个数比1∶1形成的化合物的电子式为
________________。
⑵人们通常把拆开l mol某化学键所吸收的能量看成该化学键
的键能。键能的大小可以衡量化学键的强弱。也可以用于估
算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-----D |
F------F |
B------B |
F------B |
C-------D |
D-------D |
|
键能(KJ·
mol-1) |
460 |
176 |
347.7 |
347 |
745 |
479.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用abc表示): _______。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算1molF单质晶体完全燃烧的反应热:ΔH= 。
|
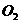 的体积(标准状况)是
L,溶液的
的体积(标准状况)是
L,溶液的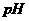 是
。反应速率v(Cu2+):v(O2)==
是
。反应速率v(Cu2+):v(O2)==
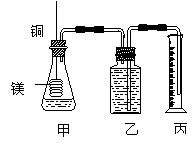 (4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差
g ,电解液的
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差
g ,电解液的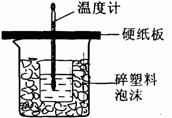 3.(8分)50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
3.(8分)50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。