20. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
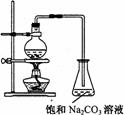 (1)欲提高乙酸的转化率,可采取的措施有:
、
等。
(1)欲提高乙酸的转化率,可采取的措施有:
、
等。
(2)若用右图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为: 、 等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
|
同一反应时间 |
同一反应温度 |
||||
|
反应温度/℃ |
转化率(%) |
选择性(%)* |
反应时间/h |
转化率(%) |
选择性(%)* |
|
40 |
77.8 |
100 |
2 |
80.2 |
100 |
|
60 |
92.3 |
100 |
3 |
87.8 |
100 |
|
80 |
92.6 |
100 |
4 |
92.3 |
100 |
|
120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
|
*选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A 120℃,4h B 80℃,2h C 60℃,4h D 40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为 。
19. “碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t
/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A <22.0s B 22.0-44.0s C >44.0s D 数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
16.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:
2A(g)+B(g) 2C(g);△H<0
2C(g);△H<0
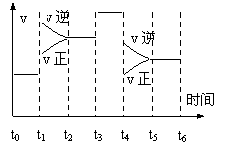
达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
|
|
X |
Y |
|
A |
再加入A |
B的转化率 |
|
B |
再加入C |
A的体积分数 |
|
C |
增大体积 |
A的转化率 |
|
D |
降低温度 |
混合气体的密度 |
 一密闭容器中发生下列反应:
一密闭容器中发生下列反应: 2NH3(g);ΔH<0
2NH3(g);ΔH<0 2C(g)+D(g);△H<0。现将1mol
A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H<0。现将1mol
A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
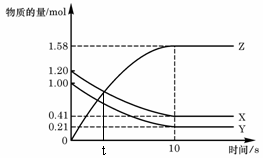 一定温度下,在2 L的密闭容器中,X、Y、Z
一定温度下,在2 L的密闭容器中,X、Y、Z 2Z(g)
2Z(g) C8H8(g)
+ H2(g)
C8H8(g)
+ H2(g)
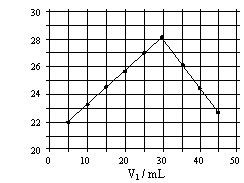 将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )