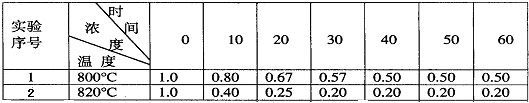
摘要:34.某化学反应2A B+D在四种不同条件下进行.B.D起始浓度为0.反应物A的浓度的变化情况如下表: 实验序号 浓度 时间(min) 0 10 20 30 40 50 60 1 温 度 8000C 1.0 0.80 O.67 0.57 0.50 0.50 0.50 2 8000C C2 0.60 0.50 0.50 0.50 0.50 0.50 3 8000C C3 0.92 0.75 0.63 0.60 0.60 0.60 4 8200C 1.0 0.40 0.25 0.20 0.20 0.20 0.20 根据上述数据.完成下列填空: (1)在实验1.反应在0至20分钟时间内平均速率为 mol/. (2)在实验2.A的初始浓度c2= mol/L.反应在 20分钟内就达到平衡.可推测实验2中还隐含的条件是 . (3)设实验3的反应速率为v3.实验1的反应速率为v1.则达到平衡时v3 v1(填>.=.<=.且c3= mol/L. (4)比较实验4和实验1.可推测该反应是 反应. 理由是 (5) 800℃时,反应2A B+D的平衡常数= , 其他条件不变, B.D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= . 注意:非选择题应在答卷上相应的区域作答. 第8页 高二化学试题[答卷] 命题:郑元庆 班级 第I卷 选择题 一.单项选择题 姓 名
网址:http://m.1010jiajiao.com/timu3_id_264833[举报]
某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0及反应A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0及反应A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为
(3)设实验2反应速率为V3,实验1的反应速率为V1,任一相同时刻,则V3
查看习题详情和答案>>
 B+D在四种不同条件下进行,B、D起始浓度为0及反应A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0及反应A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为
0.013
0.013
mol/(L?min).(3)设实验2反应速率为V3,实验1的反应速率为V1,任一相同时刻,则V3
>
>
V1(填>、=、<).某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内A的平均速率为
(2)在实验2,A的初始浓度c2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(4)比较实验4和实验1,可推测该可逆反应的正反应是
(5)四组实验中,平衡常数大小关系K1
查看习题详情和答案>>
| 实验 序号 |
温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.60 |
(1)在实验1,反应在10至20分钟时间内A的平均速率为
0.013
0.013
mol/(L?min).(2)在实验2,A的初始浓度c2=
1.0
1.0
mol/L.(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
>
>
v1(填>、=、<),且c3>
>
1.0mol/L(填>、=、<)(4)比较实验4和实验1,可推测该可逆反应的正反应是
吸热
吸热
反应(填“吸热”或“放热”),理由是升温,A平衡浓度减小,说明升温平衡向正反应方向移动,所以正向吸热
升温,A平衡浓度减小,说明升温平衡向正反应方向移动,所以正向吸热
.(5)四组实验中,平衡常数大小关系K1
=
=
K2=
=
K3<
<
K4(填>、=、<).某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
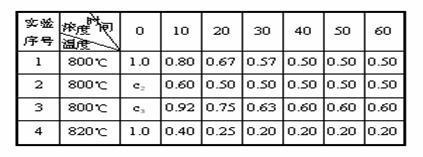
根据上述数据,完成下列填空:
⑴在实验1,反应在10至20min时间内平均速率为 mol?(L?min)-1。
⑵在实验2,A的初始浓度c2= mol?L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
⑶设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1(填“>”“=”“<”),且c3 1.0mol?L-1(填“>”“=”“<”)。
⑷比较实验4和实验1,可推测该反应是 反应(选填“吸热”“放热”)。理由是 。
查看习题详情和答案>>某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内A的平均速率为______mol/(L?min).
(2)在实验2,A的初始浓度c2=______mol/L.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______v1(填>、=、<),且c3______1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该可逆反应的正反应是______反应(填“吸热”或“放热”),理由是______.
(5)四组实验中,平衡常数大小关系K1______K2______K3______K4(填>、=、<).
查看习题详情和答案>>
| 实验 序号 |
温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.60 |
(1)在实验1,反应在10至20分钟时间内A的平均速率为______mol/(L?min).
(2)在实验2,A的初始浓度c2=______mol/L.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______v1(填>、=、<),且c3______1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该可逆反应的正反应是______反应(填“吸热”或“放热”),理由是______.
(5)四组实验中,平衡常数大小关系K1______K2______K3______K4(填>、=、<).