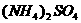0 24228 24236 24242 24246 24252 24254 24258 24264 24266 24272 24278 24282 24284 24288 24294 24296 24302 24306 24308 24312 24314 24318 24320 24322 24323 24324 24326 24327 24328 24330 24332 24336 24338 24342 24344 24348 24354 24356 24362 24366 24368 24372 24378 24384 24386 24392 24396 24398 24404 24408 24414 24422 447348