0 24287 24295 24301 24305 24311 24313 24317 24323 24325 24331 24337 24341 24343 24347 24353 24355 24361 24365 24367 24371 24373 24377 24379 24381 24382 24383 24385 24386 24387 24389 24391 24395 24397 24401 24403 24407 24413 24415 24421 24425 24427 24431 24437 24443 24445 24451 24455 24457 24463 24467 24473 24481 447348
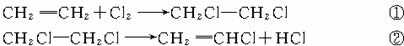
 ×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯_______t;同时得到副产物氯化氢_______t。(计算结果保留1位小数)
×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯_______t;同时得到副产物氯化氢_______t。(计算结果保留1位小数) 2CH2Cl-CH2Cl+2H2O ③
2CH2Cl-CH2Cl+2H2O ③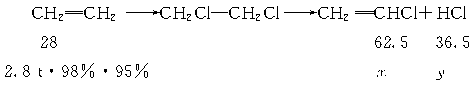
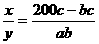
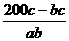 。
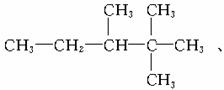
。
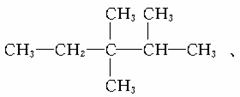
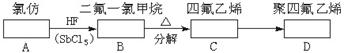
 C:_______;C
C:_______;C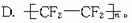
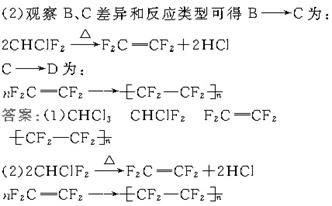 ?
?