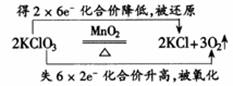
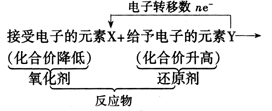
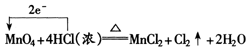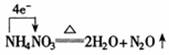2. 氧化剂、还原剂之间反应规律
(1)对于氧化剂来说,同族元素的非金属原子,它们的最外层电子数相同而电子层数不同时,电子层数越多,原子半径越大,就越难得电子。因此,它们单质的氧化性就越弱。
(2)金属单质的还原性强弱一般与金属活动顺序相一致。
(3)元素处于高价的物质具有氧化性,在一定条件下可与还原剂反应,在生成的新物质中该元素的化合价降低。
(4)元素处于低价的物质具有还原性,在一定条件下可与氧化剂反应,在生成的新物质中该元素的化合价升高。
(5)稀硫酸与活泼金属单质反应时,是氧化剂,起氧化作用的是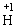 ,被还原生成H2,浓硫酸是强氧化剂,与还原剂反应时,起氧化作用的是
,被还原生成H2,浓硫酸是强氧化剂,与还原剂反应时,起氧化作用的是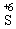 ,被还原后一般生成SO2。
,被还原后一般生成SO2。
(6)不论浓硝酸还是稀硝酸都是氧化性极强的强氧化剂,几乎能与所有的金属或非金属发生氧化还原反应,反应时,主要是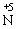 得到电子被还原成NO2,NO等。一般来说浓硝酸常被还原为NO2,稀硝酸常被还原为NO。
得到电子被还原成NO2,NO等。一般来说浓硝酸常被还原为NO2,稀硝酸常被还原为NO。
(7)变价金属元素,一般处于最高价时的氧化性最强,随着化合价降低,其氧化性减弱,还原性增强。
氧化剂与还原剂在一定条件下反应时,一般是生成相对弱的还原剂和相对弱的氧化剂,即在适宜的条件下,可用氧化性强的物质制取氧化性弱的物质,也可用还原性强的物质制取还原性弱的物质。
常见的氧化性、还原剂及其还原产物、氧化产物,填写下表
|
氧化剂 |
还原产物 |
还原剂 |
氧化产物 |
|
O2 |
|
活泼金属 |
|
|
Cl2,Br2,I2 |
|
H2 |
|
|
浓H2SO4 |
|
C |
|
|
HNO3 |
|
Si |
|
|
MnO4- |
|
CO |
|
|
Fe3+ |
|
Fe2+ |
|
|
Na2O2,H2O2 |
|
SO2,SO32- |
|
答案:
|
氧化剂 |
还原产物 |
还原剂 |
氧化产物 |
|
O2 |
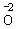 , ,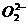 |
活泼金属 |
金属离子 |
|
Cl2,Br2,I2 |
Cl-,Br-,I- |
H2 |
H2O,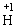 |
|
浓H2SO4 |
SO2,S,H2S |
C |
CO,CO2 |
|
HNO3 |
NO,NO2,NH4+ |
Si |
SiO2,SiCl4 |
|
MnO4- |
Mn2+,MnO2、MnO42- |
CO |
CO2 |
|
Fe3+ |
Fe2+,Fe |
Fe2+ |
Fe3+ |
|
Na2O2,H2O2 |
O2-,H2O |
SO2,SO32- |
SO3,SO42- |
 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
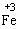 ,而与弱氧化剂(如H+,S等)反应被氧化为
,而与弱氧化剂(如H+,S等)反应被氧化为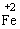 ;且
;且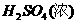 )等氧化为
)等氧化为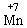 、
、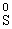 和
和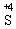 。
。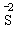 。
。