2、(2009·哈尔滨)区分下列各组物质.所用的两种方法都正确的是 ( )
|
选项 |
需区分的物质 |
方法一 |
方法二 |
|
A |
硝酸铵与氯化钠 |
观察颜色 |
加水溶解并触摸容器外壁 |
|
B |
碳酸钾溶液与氢氧化钾溶液 |
滴加稀盐酸 |
滴加氢氧化钙溶液 |
|
C |
羊毛与绦纶 |
点燃闻气味 |
观察颜色 |
|
D |
氢气与氧气 |
用燃着的木条 |
闻气味 |
3、常用除杂的方法
①常用的物理方法
根据物质物理性质上的差异选择除杂的方法。有过滤、蒸发结晶、降温结晶、蒸馏、分馏、萃取、分液、渗析、升华等方法。
②常用的化学方法
吸收法:常用于气体的净化和干燥,可根据被提纯气体中所含杂质气体的性质,选择适当的固体或溶液作为吸收剂。如Cl2中混有的HCl气体可通过饱和食盐水除去。常用装置是洗气瓶或干燥管(U形管)。
沉淀法:在被提纯的物质中加入适量试剂使其与杂质反应,生成沉淀过滤除去。如硝酸钾中含有的少量硝酸钡,可用适量的硫酸钾除去。
气体法:根据物质中所含杂质的性质加入合适的试剂,让杂质转化为气体除去。如KCl中混有的少量K2CO3,可加适量盐酸除去。
转化法:利用化学反应,加入适当的试剂或采用某种条件(如加热),使物质中的杂质转化为被提纯物质,以正盐、酸式盐间的转化最为常见。如:
NaHCO3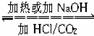 Na2CO3。
Na2CO3。
溶解法:对于固体试剂可选择适当的物质将杂质溶解,然后过滤除去,以杂质为两性物质常见。
[例2](2009·泰州)为了除去物质中的杂质(括号内物质为杂质),所选用试剂和操作方法都正确的是( )
|
|
物 质 |
选用试剂(过量) |
操作方法 |
|
A |
CO2(CO) |
O2 |
点燃 |
|
B |
Cu(Fe) |
稀盐酸 |
加入稀盐酸充分反应后过滤、洗涤 |
|
C |
CuSO4溶液(H2SO4) |
氧化铜 |
加入氧化铜粉末充分反应后过滤 |
|
D |
盐酸(H2SO4) |
硝酸钡溶液 |
加入硝酸钡溶液充分反应后过滤 |
[答案]BC
[解析]CO2中混有CO,无法点燃;Cu不与盐酸反应,而Fe可以和盐酸反应生成可溶性的氯化亚铁;H2SO4与氧化铜反应生成CuSO4;H2SO4和硝酸钡反应会增加新的杂质硝酸。
[规律小结]用化学方法除杂时要注意:①最好不引入新的杂质;②不能损耗或减少被提纯物质的质量③实验操作要简便,不能繁杂。用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去。
变式训练二
2、常见离子的检验
|
物质 |
检验试剂 |
反应现象 |
结论或化学方程式 |
|
OH- |
无色酚酞试液 |
无色酚酞试液变红色 |
---- |
|
CO32- |
稀盐酸 |
产生使澄清石灰水变浑浊的气体 |
CaCO3+2HCl=CaCl2+H2O+CO2↑ |
|
Cl- |
硝酸银溶液和稀硝酸 |
产生不溶于稀硝酸的白色沉淀 |
HCl+AgNO3=AgCl↓+HNO3 |
|
SO42- |
硝酸钡溶液 |
产生不溶于稀硝酸的白色沉淀 |
H2SO4+Ba(NO3)2=BaSO4↓+HNO3 |
|
NH4+ |
熟石灰 |
有刺激性气味的气体产生 |
2NHCl4+Ca(OH)2= CaCl2+2NH3↑+2H2O |
1、常见气体的检验方法及现象
|
物质 |
检验试剂或方法 |
反应现象 |
结论或化学方程式 |
|
O2 |
带火星的木条 |
木条复燃 |
氧气能支持燃烧 |
|
CO2 |
澄清的石灰水 |
澄清的石灰水变浑浊 |
CO2+ Ca(OH) 2=CaCO3↓+H2O |
|
H2 |
点燃,在火焰上方罩一个冷而干燥的烧杯。 |
烧杯内壁产生水珠 |
2H2+O2点燃2H2O |
|
CO |
点燃,在火焰上方罩一个内壁涂有澄清石灰水的烧杯 |
烧杯内壁变得浑浊 |
2CO+O2点燃 2CO2 |
|
CH4 |
点燃,在火焰上方罩一个冷而干燥的烧杯一会,迅速把烧杯倒过来,向烧杯内注入澄清的石灰水。 |
烧杯内壁有水珠,石灰水变浑浊 |
CH4+2O2点燃 CO2+2H2O |