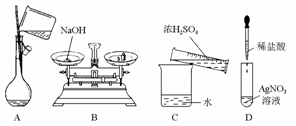
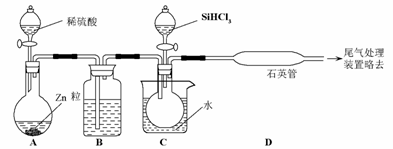
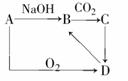
0 23836 23844 23850 23854 23860 23862 23866 23872 23874 23880 23886 23890 23892 23896 23902 23904 23910 23914 23916 23920 23922 23926 23928 23930 23931 23932 23934 23935 23936 23938 23940 23944 23946 23950 23952 23956 23962 23964 23970 23974 23976 23980 23986 23992 23994 24000 24004 24006 24012 24016 24022 24030 447348