25. (10分)已知有关物质的熔、沸点数据如下表:
|
|
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
熔点(℃) |
2852 |
2045 |
714 |
190(2.5×105Pa) |
|
沸点(℃) |
3600 |
2980 |
1412 |
177.8 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁;用电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因是:___▲____; AlCl3可能为___▲____晶体。
(2)请设计可靠的实验证明MgCl2、AlCl3所属化合物的类型,其实验方法是_____▲____ 。
(3)AlCl3具有以下__▲__特殊性质(请填序号)。①液化 ②挥发 ③升华
23. (8分)下表为元素周期表的一部分,请回答有关问题:
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0A |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号是__▲__和__▲__ ;
(2)表中最活泼的金属是__▲_ ,非金属性最强的元素是_▲__(填写元素符号);
(3)表中能形成两性氢氧化物的元素是__▲_ ,分别写出该元素的氢氧化物与⑥最高价氧化物对应水化物反应的化学方程式: ___________▲____________ ,
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:_________▲_________ 。
(5)0.1 mol的单质⑦与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+ 和Br-的物质的量之比是: __▲__。
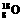 ,②
,② ,③
,③ ,④
,④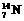 。(填序号)
。(填序号)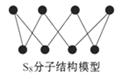 A.S2、S4、S6、S8互为同位素
A.S2、S4、S6、S8互为同位素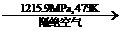 黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是.k*s5*u
黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是.k*s5*u