1.理想气体状态方程
理想气体又称“完全气体”(perfect gas),是理论上假想的一种把实际气体性质加以简化的气体。人们把假想在任何情况下都严格遵守气体三定律的气体称为理想气体。理想气体具有如下特点:
①分子体积与气体体积相比可以忽略不计
②分子之间没有相互吸引力
③分子之间及分子与器壁之间发生的碰撞不造成动能损失
一切实际气体并不严格遵循这些定律,只有在温度不太低,压强不太高时可将真实气体视为理想气体。换言之,理想气体是一种理想化的模型,实际并不存在。理想气体是一切实际气体压强趋于零的极限。这是因为p→0时,V→∞,即分子间距很大。此时分子本身体积和分子间引力均可忽略不计。实际气体中,凡是本身不易被液化的气体,它们的性质很近似理想气体,其中最接近理想气体的是氢气和氦气。
在各种温度、压强的条件下,其状态皆服从方程pV=nRT的气体,称为理想气体状态方程,或称理想气体定律。式中p是气体分压,V是气体体积,n是气体物质的量,T是气体的绝对温度,R是气体通用常数,它随其他物理量的单位不同而不同。
|
物理量 |
p |
V |
n |
T |
R |
|
国际单位 |
Pa |
m3 |
mol |
K |
8.314 |
|
kPa |
dm3 |
mol |
K |
8.314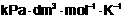 |
|
|
常用单位 |
atm |
dm3 |
mol |
K |
0.082 |
 ~p图。试根据图求出CH3F摩尔质量。
~p图。试根据图求出CH3F摩尔质量。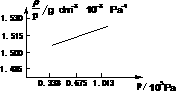
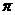 和溶液的体积摩尔浓度成正比;②浓度相同时,
和溶液的体积摩尔浓度成正比;②浓度相同时,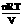 ,即
,即