32、(6分)将含过量氧气和乙烯及某烷烃组成的混合气体20L,点燃爆炸反应后,气体体积仍为20L(120℃,1.01×105Pa),然后将气体通过足量的碱石灰,剩余气体2L,若仅通过浓硫酸,则体积变为10L。求烷烃的分子式及原来乙烯的体积。
|
|
|
|
|
题 |
|
名 姓 |
答 |
|
|
准 |
|
号 学 |
不 |
|
|
内 线 |
|
级 班 |
封 |
|
|
密 |
|
校 学 |
|
|
|
|
高一化学限时试卷答卷纸
28、(5分)1932年美国化学家鲍林首先提出电负性的概念。电负性(用X表示)也是元一种衡量元素金属性和非金属的重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:请仔细分析下表数据,回答下列有关问题:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:___________< X <___________。
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是_______________________。
27、(19分)(1)①下表为烯烃类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
|
烯烃类化合物 |
相对速率 |
|
(CH3)2C=CHCH3 |
10.4 |
|
CH3CH=CH2 |
2.03 |
|
CH2=CH2 |
1.00 |
|
CH2=CHBr |
0.04 |
据表中数据,总结烯烃类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:(4分)
____________________________________ _ _____ 。
②(2分)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是______________(填代号)。
A.(CH3)2C=C(CH3) 2 B.CH3CH=CHCH3
C.CH2=CH2 D.CH2=CHCl
(2)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
①(2分)写出A的电子式 。
②(2分)B、D分子中的官能团名称分别是 、 。
③(3分)写出下列反应的反应类型:① ,② ,④ 。
④写出下列反应的化学方程式:(6分)
① ;
② ;
④ 。
26、(10分)周期表里的四种主族元素相对位置如右图所示。已知它们的原子序数总和为46,则
|
m |
n |
|
|
|
|
|
x |
y |
(1)元素n的原子序数为 ;
(2)用电子排布式表示x原子的价电子结构 ;
(3)m与y所形成的化合物的化学式是 。
(4)X与y相比,电负性较大的是 ,理由是 。
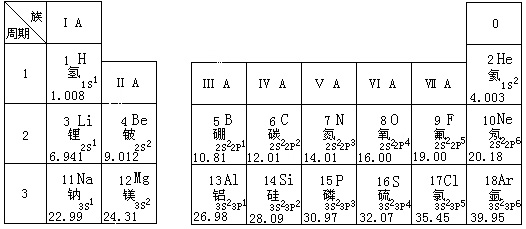 (6分)根据你对下列元素周期表的理解,回答有关问题:
(6分)根据你对下列元素周期表的理解,回答有关问题: