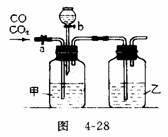
 21(7分)某学生用图4-28的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
21(7分)某学生用图4-28的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
(1)甲瓶内盛 溶液,乙瓶内盛 溶液,分液漏斗内盛 溶液。
(2)实验先分离出一氧化碳,方法是先关闭 ,再打开 。
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭 ,再打开 。
22 (6分) 甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种,将它们两两混合后,观察到如图所示的现象,其中丁与乙产生的是无色气体。
|
|
甲 |
乙 |
丙 |
丁 |
|
甲 |
- |
↓ |
↓ |
- |
|
乙 |
↓ |
- |
↓ |
↑ |
|
丙 |
↓ |
↓ |
- |
↓ |
|
丁 |
- |
↑ |
↓ |
- |
请回答下列问题:
⑴写出丁与乙反应的离子方程式
⑵这四种溶液中溶质的化学式分别是:甲 ,乙 ,丙 ,丁 。
16 (6分)若实验室用氯水和KSCN溶液检某溶液中有无Fe2+,应在待测试液中先加入 、后加入 。若看到 ,说明含Fe2+。
17(8分)有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)溶液中加入一定量Ba(OH)2(强碱)溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
根据上述实验,这包粉末中一定不含有的离子是 ,肯定含有的离子是
,不能确定是否含有的离子是 ,可通过 来进一步确定该离子。
18(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
19(6分)(1)正常雨水显 性,其pH约值等于 ,这是由于 ____ 。
(2)某次采集的酸雨样品,每隔一段时间测定一次pH值,得数据如下
|
时间 |
开始 |
8h后 |
16h后 |
24h后 |
32h后 |
40h后 |
48h后 |
|
pH |
5.0 |
4.8 |
4.6 |
4.3 |
4.2 |
4.0 |
4.0 |
酸雨样品pH值变小的主要原因是
。
20(6分)(市一中做)某无色透明溶液,跟金属铝反应生成H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、SO32-、HCO3-、、OH-、NO3-,哪些可能是构成此溶液的成分?
(1)生成Al3+时,可能存在
(2)当生成AlO2-时,可能存在
20(6分)(大丰中学做)X、Y、Z、W四种元素,都位于周期表中的短周期,且原子序数X<Y<Z<W。X原子和Y原子的最外层电子数之和与Z原子最外层电子数相等。X的原子半径为自然界元素中原子半径最小的。W原子和Y原子最外层电子数之和为Z原子最外层电子数的2倍。W原子最外层电子数为其电子层数的3倍。⑴这四种元素的名称分别为:X ,Y ,Z ,W 。⑵由这四种元素可组成某种盐,该盐既能与盐酸反应,又能与氢氧化钠溶液反应。该盐的化学式为