摘要:周期表里的四种主族元素相对位置如右图所示.已知它们的原子序数总和为46.则 m n x y (1)元素n的原子序数为 , (2)用电子排布式表示x原子的价电子结构 , (3)m与y所形成的化合物的化学式是 . (4)X与y相比.电负性较大的是 .理由是 .
网址:http://m.1010jiajiao.com/timu3_id_171992[举报]
 M、N、X、Y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46.
M、N、X、Y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46.(1)M与Y形成的化合物中含
极性
极性
键,属非极性
非极性
分子(填“极性”或“非极性”).(2)N元素形成的单质分子中的化学键类型及数目是
一个σ键、两个π键
一个σ键、两个π键
(填“σ键”或“π键”).在化学反应中π键
π键
易断裂.(3)由N、Y的氢化物相互作用所生成的物质的电子式为


离子键、共价键、配位键
离子键、共价键、配位键
.(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
| 质子数 | 16 | 16 | 16 |
| 电子数 | 16 | 17 | 18 |
| 化学式 |
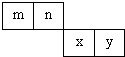 m、n、x、y 四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
m、n、x、y 四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:(1)元素n的气态氢化物的电子式为
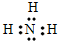
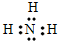
(2)m与y所形成的化合物含
极性
极性
键(3)x的原子结构示意图为


(4)由n、y的氢化物相互作用所生成的物质的化学式为
NH4Cl
NH4Cl
.
m、n、x、y四种主族元素在周期表里的相对位置如下图所示。

已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的化学式为__________。
(2)y的单质通入石灰乳中所生成的具有漂白性,其漂白原理是__________________(用化学方程式表示)。
(3)x的原子结构示意图为___________________________________。
(4)检验y的-1价阴离子的离子方程式为____________________________。
查看习题详情和答案>>
m、n、x、y四种主族元素在周期表里的相对位置如下图所示。已知它们的原子序数总和为46,则:
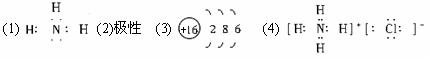
(1)元素n的气态氢化物的电子式为________。
(2)m与y所形成的化合物含________键。
(3)x的原子结构示意简图为________。
(4)由n、y的氢化物相互作用所生成的物质的电子式为。
查看习题详情和答案>>m、n、x、y四种主族元素在周期表里的相对位置如下所示,已知它们的原子序数总和为46。
| m | n | ||
| x | y |
(1)m与y形成的化合物中含 键,属 分子(填“极性”或“非极性”)。
(2)由n、y的氢化物相互作用所生成的物质的电子式为 。
(3)写出m单质与x元素最高价氧化物对应的水化物反应的化学方程式为
。
(4)核电荷数比x元素少8的元素可形成多种粒子,按要求填入空格中:
| 质子数 | 16 | 16 | 16 |
| 电子数 | 16 | 17 | 18 |
| 化学式 |