0 15417 15425 15431 15435 15441 15443 15447 15453 15455 15461 15467 15471 15473 15477 15483 15485 15491 15495 15497 15501 15503 15507 15509 15511 15512 15513 15515 15516 15517 15519 15521 15525 15527 15531 15533 15537 15543 15545 15551 15555 15557 15561 15567 15573 15575 15581 15585 15587 15593 15597 15603 15611 447348
 MnCl2+ Cl2↑+2H2O
MnCl2+ Cl2↑+2H2O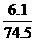 =0.082mol,
=0.082mol,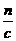
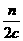
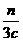
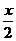 +
+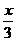 =
=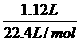 ,
,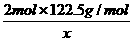 =
=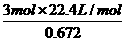 ,解得:x=2.45g.
,解得:x=2.45g.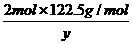 =
=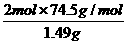 ,解得:y=2.45g.
,解得:y=2.45g.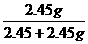 ×100%=50%
×100%=50%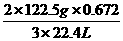 =1.49g即甲分解时得到KCl的质量为1.49g,由此可算出甲实验时KClO3的分解质量:
=1.49g即甲分解时得到KCl的质量为1.49g,由此可算出甲实验时KClO3的分解质量: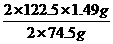 =2.45g
=2.45g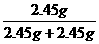 ×100%=50%
×100%=50%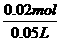 =0.4mol·L-1
=0.4mol·L-1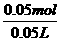 =1mol/L
=1mol/L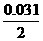 =0.015mol.
=0.015mol.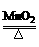 2KCl + 3O2↑
2KCl + 3O2↑