网址:http://m.1010jiajiao.com/timu3_id_155145[举报]
①已知在
②已知在
③已知在
(2)三种不同溶液的计算结果,都表达了溶液的体积和溶质的物质的量的什么关系?
查看习题详情和答案>>完成下列填空:
①已知在0.5 L NaCl溶液中含有0.5 mol NaCl,则1 L NaCl溶液中含NaCl________mol.
②已知在2 L NaOH溶液中含有4 mol NaOH,则1 L NaCl溶液中含NaOH________mol.
③已知在4 L H2SO4溶液中含有12 mol H2SO4,则1 L H2SO4溶液中含H2SO4________mol.
(1)完成下列填空:
①已知在0.5 L NaCl溶液中含有0.5 mol NaCl,则1 LNaCl溶液中含NaCl________mol.
②已知在2 L NaOH溶液中含有4 mol NaOH,则1 L NaCl溶液中含NaOH________mol.
③已知在4 L H2SO4溶液中含有12 mol H2SO4,则1 L H2SO4溶液中含H2SO4________mol.
(2)三种不同溶液的计算结果,都表达了溶液的体积和溶质的物质的量的什么关系?
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol.该金属M的相对原子质量为
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL.将B投入过量烧碱溶液中,未检测出NH3的逸出.则B的化学式可表示为
(3)已知在图中,L的位置完全相同.现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似图.
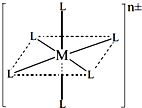
如果该配离子共有2种不同结构,该配离子的式量为
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2.则该盐的式量以及物质的量分别为
高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂。M元素的离子在一定条件下能与NH3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团)。
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol。该金属M的相对原子质量为___________。
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为
_______mol·L-1。
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL。将B投入过量烧碱溶液中,未检测出NH3的逸出。则B的化学式可表示为 。
(3)已知在下图中,L的位置完全相同。现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似下图。
如果该配离子共有2种不同结构,该配离子的式量为 。
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2。则该盐的式量以及物质的量分别为_______________。