5.(2010山东邹城中考模拟)小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8 g这种石灰石样品,把40 g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
(1)8 g石灰石样品中含有杂质多少克?
(2)样品中碳酸钙的质量分数是多少?
(3)下表中m的数值应该为多少?
|
序号 |
加入稀盐酸质量/g |
剩余固体质量/g |
|
第1次 |
10 |
5.5 |
|
第2次 |
10 |
M |
|
第3次 |
10 |
1.2 |
|
第4次 |
10 |
1.2 |
(4)要得到280 kg CaO,需要质量分数为80%的石灰石多少千克?(化学方程式:CaCO3 CaO+CO2↑)
CaO+CO2↑)
思路解析:(1)8 g石灰石样品中含有杂质为1.2 g。
(2)样品中碳酸钙的质量分数= =85%
=85%
(3)m=5.5 g-(8 g-5.5 g)=3 g
(4)设需要80%的石灰石的质量为x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56
x×80% 280kg
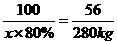
x=625 kg
此题通过不断改变所加入的稀盐酸的质量,观察剩余固体的质量来判断稀盐酸何时不足,石灰石中CaCO3何时完全反应。由表中数据可知,在第三次加入10 g盐酸后,固体剩余物质量不再减少,说明剩余的1.2 g固体不和稀盐酸反应,应为杂质。然后,用8 g石灰石样品质量-杂质质量=CaCO3质量。再除以样品质量,即可求出样品中碳酸钙的质量分数。第三小问也可从题意得出正解,即第一次加10 g酸时固体的质量减少应和第二次一样,所以第二次剩余的固体质量就是3 g。最后一问可利用含杂质问题的解题方法处理。
答案:(1)1.2 g (2)85% (3)3 g (4)625 kg
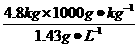 =3 356.6 L
=3 356.6 L K2MnO4+ MnO2+ O2↑
K2MnO4+ MnO2+ O2↑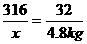
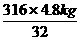 =47.4 kg
=47.4 kg