3. 金属的化学性质:
金属的化学性质:
(1)金属与氧气反应:大多数金属都可以与氧气反应,但是反应需要的条件不同
A:镁与氧气反应:
1)常温下:2Mg+O2 =2MgO

2)点燃时:4Al+3O2 ====2Al2O3
现象:剧烈燃烧,放出大量的热和耀眼的白光,生成白色固体。
C:铁与氧气反应:
1) 常温下:干燥的条件不反应,但是在潮湿的环境下反应:铁与空气中的氧气和水共同作用下会生成暗红色疏松的物质--铁锈(Fe2O3·H2O)
|
2) 点燃时:3Fe+2O2 ======Fe3O4
现象:剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。
D:铜与氧气反应:
1) 常温条件下:干燥的环境不进行反应,但是在潮湿的条件下:
2Cu+O2+CO2+H2O=Cu2(OH)2CO3
现象:铜表面生成一层绿色物质
|
2) 加热时:2Cu+O2 =====2CuO
现象:铜丝表面逐渐变为黑色
E:Au、Ag即使在高温的情况下也不与氧气反应
(2)金属与酸反应:
金属 + 酸 → 盐 + H2↑ 置换反应(条件:活动性:金属>H )

 H2SO4 + Mg
MgSO4 + H2↑ 2HCl
+ Mg
MgCl2+ H2↑
H2SO4 + Mg
MgSO4 + H2↑ 2HCl
+ Mg
MgCl2+ H2↑
现象:反应剧烈,有大量气泡产生,液体仍为无色

 3H2SO4
+ 2Al
Al2(SO4)3 + 3H2↑ 6HCl +
2Al
2AlCl3+ 3H2↑
3H2SO4
+ 2Al
Al2(SO4)3 + 3H2↑ 6HCl +
2Al
2AlCl3+ 3H2↑
现象:反应剧烈,有大量气泡产生,液体仍为无色

 H2SO4
+Zn
ZnSO4 + H2↑
2HCl +Zn ZnCl2
+ H2↑
H2SO4
+Zn
ZnSO4 + H2↑
2HCl +Zn ZnCl2
+ H2↑
现象:反应比较剧烈,有大量气泡产生,液体仍为无色

 H2SO4 + Fe FeSO4 + H2↑
2HCl + Fe FeCl2+
H2↑
H2SO4 + Fe FeSO4 + H2↑
2HCl + Fe FeCl2+
H2↑
现象:反应比较缓慢,有气泡产生,液体由无色变为浅绿色
铜与酸不反应
注:通过以上的实验现象可以得出结论:Mg、Zn、Fe的金属活动性比铜强,它们能置换出稀硫酸或稀盐酸中的氢。
(3) 金属与盐反应:金属 + 盐 → 另一金属 + 另一盐
置换反应(条件:参加反应的金属活泼性>化合物中金属元素的)
A:铁丝浸入硫酸铜溶液中:
Fe+CuSO4= Cu+FeSO4
现象:浸入溶液的铁钉表面覆盖一层紫红色的物质,溶液由蓝色逐渐变为浅绿色
B:铝丝浸入硫酸铜溶液中:
Cu+2AgNO3=Cu(NO3)2+2Ag
现象:浸入溶液的铜丝表面覆盖一层银白色的物质,溶液由无色逐渐变为蓝色
C:铜丝浸入硝酸银溶液中
Cu+2AgNO3=Cu(NO3)2+2Ag
4.把4g硫粉在给定质量的氧气中燃烧,有关实验数据如下表所示:
|
|
第一次 |
第二次 |
第三次 |
|
O2质量(g) |
3 |
4 |
6 |
|
SO2质量(g) |
6 |
|
|
请回答下列问题:
(1)第1次实验中,参加反应的S的质量、O2的质量与生成的SO2的质量比是 。
(2)请你通过计算求出第2次实验生成二氧化硫多少克?
(3)在表中填写第3次实验生成二氧化硫的质量。
 常见溶液的颜色:CuSO4溶液:蓝色 FeSO4 、FeCl2溶液:浅绿色
常见溶液的颜色:CuSO4溶液:蓝色 FeSO4 、FeCl2溶液:浅绿色 金属活动性:由强到弱
金属活动性:由强到弱
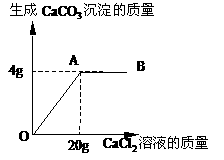 碳酸钠和氯化钠的混合物14g,常温溶解在足量水中,向溶液中逐滴加入氯化钙溶液。加入氯化钙溶液的质量与生成的CaCO3沉淀的质量的关系如图
碳酸钠和氯化钠的混合物14g,常温溶解在足量水中,向溶液中逐滴加入氯化钙溶液。加入氯化钙溶液的质量与生成的CaCO3沉淀的质量的关系如图