摘要:金属的化学性质: (1)金属与氧气反应:大多数金属都可以与氧气反应.但是反应需要的条件不同 A:镁与氧气反应: 1)常温下:2Mg+O2 =2MgO 2)点燃时:4Al+3O2 ====2Al2O3 现象:剧烈燃烧.放出大量的热和耀眼的白光.生成白色固体. C:铁与氧气反应: 1) 常温下:干燥的条件不反应.但是在潮湿的环境下反应:铁与空气中的氧气和水共同作用下会生成暗红色疏松的物质--铁锈(Fe2O3·H2O) 点燃 2) 点燃时:3Fe+2O2 ======Fe3O4 现象:剧烈燃烧.火星四射.放出大量的热.生成一种黑色固体. D:铜与氧气反应: 1) 常温条件下:干燥的环境不进行反应.但是在潮湿的条件下: 2Cu+O2+CO2+H2O=Cu2(OH)2CO3 现象:铜表面生成一层绿色物质 △ 2) 加热时:2Cu+O2 =====2CuO 现象:铜丝表面逐渐变为黑色 E:Au.Ag即使在高温的情况下也不与氧气反应 (2)金属与酸反应: 金属 + 酸 → 盐 + H2↑ 置换反应 H2SO4 + Mg MgSO4 + H2↑ 2HCl + Mg MgCl2+ H2↑ 现象:反应剧烈.有大量气泡产生.液体仍为无色 3H2SO4 + 2Al Al2(SO4)3 + 3H2↑ 6HCl + 2Al 2AlCl3+ 3H2↑ 现象:反应剧烈.有大量气泡产生.液体仍为无色 H2SO4 +Zn ZnSO4 + H2↑ 2HCl +Zn ZnCl2 + H2↑ 现象:反应比较剧烈.有大量气泡产生.液体仍为无色 H2SO4 + Fe FeSO4 + H2↑ 2HCl + Fe FeCl2+ H2↑ 现象:反应比较缓慢.有气泡产生.液体由无色变为浅绿色 铜与酸不反应 注:通过以上的实验现象可以得出结论:Mg.Zn.Fe的金属活动性比铜强.它们能置换出稀硫酸或稀盐酸中的氢. (3) 金属与盐反应:金属 + 盐 → 另一金属 + 另一盐 置换反应(条件:参加反应的金属活泼性>化合物中金属元素的) A:铁丝浸入硫酸铜溶液中: Fe+CuSO4= Cu+FeSO4 现象:浸入溶液的铁钉表面覆盖一层紫红色的物质.溶液由蓝色逐渐变为浅绿色 B:铝丝浸入硫酸铜溶液中: Cu+2AgNO3=Cu(NO3)2+2Ag 现象:浸入溶液的铜丝表面覆盖一层银白色的物质.溶液由无色逐渐变为蓝色 C:铜丝浸入硝酸银溶液中 Cu+2AgNO3=Cu(NO3)2+2Ag
网址:http://m.1010jiajiao.com/timu3_id_13868[举报]
金属与氧气的反应
(1)镁、铝在常温下就能反应,其化学方程式分别为______;______.
(2)铁、铜在温度较高时能与氧气反应,其化学方程式分别为:______;______.
(3)“真金不怕火炼”是金在高温下也不与______反应,说明了金的化学性质______.
(4)铝抗腐蚀性好的原因是______.
查看习题详情和答案>>
(1)镁、铝在常温下就能反应,其化学方程式分别为______;______.
(2)铁、铜在温度较高时能与氧气反应,其化学方程式分别为:______;______.
(3)“真金不怕火炼”是金在高温下也不与______反应,说明了金的化学性质______.
(4)铝抗腐蚀性好的原因是______.
金属与人类生活、生产密不可分.
(1)把一根洁净的铁钉放入稀硫酸中,下列叙述正确的是 .
①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色
③铁钉的质量增加 ④溶液的质量减轻
(2)清末铝制艺术品至今保存完好,艺术品未被锈蚀的主要原因是 .
A.铝不易被氧化 B.铝的金属活动性比较弱 C.铝表面的氧化膜具有保护作用
(3)早在春秋战国时期,我国古代入民已经开始炼铁.磁铁矿(Fe3O4)与CO反应的化学方程式为 .钢铁防腐十分重要!请写出一种防止钢铁生锈的方法 .
(4)请从下列物质中选择适当的试剂,设计两种方法进行镁、锌、铁金属活动顺序的实验探究.
a.镁条 b.稀硫酸 c.硫酸锌 d.硫酸镁 e.锌片 f.硫酸亚铁 g.铁钉
(1)方法一所选试剂: (填序号);
(2)方法二所选试剂: (填序号).
查看习题详情和答案>>
(1)把一根洁净的铁钉放入稀硫酸中,下列叙述正确的是
①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色
③铁钉的质量增加 ④溶液的质量减轻
(2)清末铝制艺术品至今保存完好,艺术品未被锈蚀的主要原因是
A.铝不易被氧化 B.铝的金属活动性比较弱 C.铝表面的氧化膜具有保护作用
(3)早在春秋战国时期,我国古代入民已经开始炼铁.磁铁矿(Fe3O4)与CO反应的化学方程式为
(4)请从下列物质中选择适当的试剂,设计两种方法进行镁、锌、铁金属活动顺序的实验探究.
a.镁条 b.稀硫酸 c.硫酸锌 d.硫酸镁 e.锌片 f.硫酸亚铁 g.铁钉
(1)方法一所选试剂:
(2)方法二所选试剂:
金属与人类生活、生产密不可分.
(1)某小组设计如图装置来观察铁制品锈蚀的原因.
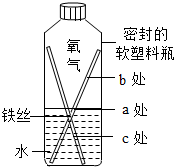
①铁生锈的条件是________;
写出一条防止课桌腿生锈的方法________.
②一段时间后,右图中可观察到________处锈蚀最严重和________的现象.
(2)锰为不锈钢主要的添加元素.锰的氧化物是不锈钢的保护膜,可以提高不锈钢的耐腐蚀性.
1相同温度下,取大小相同、表面光亮的锰、镁、铜三种金属片,分别投入足量的、质量分数相同的稀盐酸中(反应中锰的化合价为+2价),现象如表:
| 金属种类 | 锰(Mn) | 镁 | 铜 |
| 与盐酸反应 | 略慢 | 快 | 无明显现象 |
2金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系.
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | a/12 | a/28 | a/27.5 |
| 找到的规律 | |||
金属与人类生活、生产密不可分.
(1)把一根洁净的铁钉放入稀硫酸中,下列叙述正确的是______.
①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色
③铁钉的质量增加 ④溶液的质量减轻
(2)清末铝制艺术品至今保存完好,艺术品未被锈蚀的主要原因是______.
A.铝不易被氧化 B.铝的金属活动性比较弱 C.铝表面的氧化膜具有保护作用
(3)早在春秋战国时期,我国古代入民已经开始炼铁.磁铁矿(Fe3O4)与CO反应的化学方程式为______.钢铁防腐十分重要!请写出一种防止钢铁生锈的方法______.
(4)请从下列物质中选择适当的试剂,设计两种方法进行镁、锌、铁金属活动顺序的实验探究.
a.镁条 b.稀硫酸 c.硫酸锌 d.硫酸镁 e.锌片 f.硫酸亚铁 g.铁钉
(1)方法一所选试剂:______(填序号);
(2)方法二所选试剂:______(填序号).
查看习题详情和答案>>
金属与人类生活、生产密不可分.
(1)把一根洁净的铁钉放入稀硫酸中,下列叙述正确的是 _________ .
①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色
③铁钉的质量增加 ④溶液的质量减轻
(2)清末铝制艺术品至今保存完好,艺术品未被锈蚀的主要原因是 _________ .
A.铝不易被氧化 B.铝的金属活动性比较弱 C.铝表面的氧化膜具有保护作用
(3)早在春秋战国时期,我国古代入民已经开始炼铁.磁铁矿(Fe3O4)与CO反应的化学方程式为 _________ .钢铁防腐十分重要!请写出一种防止钢铁生锈的方法 _________ .
(4)请从下列物质中选择适当的试剂,设计两种方法进行镁、锌、铁金属活动顺序的实验探究.a.镁条 b.稀硫酸 c.硫酸锌 d.硫酸镁 e.锌片 f.硫酸亚铁 g.铁钉
①方法一所选试剂: _________ (填序号);
②方法二所选试剂: _________ (填序号).
查看习题详情和答案>>
(1)把一根洁净的铁钉放入稀硫酸中,下列叙述正确的是 _________ .
①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色
③铁钉的质量增加 ④溶液的质量减轻
(2)清末铝制艺术品至今保存完好,艺术品未被锈蚀的主要原因是 _________ .
A.铝不易被氧化 B.铝的金属活动性比较弱 C.铝表面的氧化膜具有保护作用
(3)早在春秋战国时期,我国古代入民已经开始炼铁.磁铁矿(Fe3O4)与CO反应的化学方程式为 _________ .钢铁防腐十分重要!请写出一种防止钢铁生锈的方法 _________ .
(4)请从下列物质中选择适当的试剂,设计两种方法进行镁、锌、铁金属活动顺序的实验探究.a.镁条 b.稀硫酸 c.硫酸锌 d.硫酸镁 e.锌片 f.硫酸亚铁 g.铁钉
①方法一所选试剂: _________ (填序号);
②方法二所选试剂: _________ (填序号).