25.(17分)已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
|
编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
溶液开始变蓝时间(min) |
||||
0.1 mol·L-1 KI溶液 |
H2O |
0.01 mol·L-1 X 溶液 |
0.1 mol·L-1 双氧水 |
1 mol·L-1 稀盐酸 |
|||
|
1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
|
2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
|
3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
|
4 |
20.0 |
0 |
10.0 |
10.0 |
40.0 |
无 |
t |
|
5 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响。实验2中m=
,n= 
(2)已知,I2与X反应时,两者物质的量之比为1:2。实验3从开始至反应进行到2.8min时,此段时间内H2O2+2H++2I-→2H2O+I2反应速率v(I-)=_________________。
(3)一定温度下,H2O2+2H++2I-→2H2O+I2反应速率可以表示为v=k·c a(H2O2)·c b (I-)·c(H+)(k为常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=___________。
②根据上表数据可知,a、b的值依次为 和 。
(4)实验5表明:硫酸铁能提高反应速率。
①催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
②试用离子方程式表示Fe2(SO4)3对H2O2+2H++2I-→2H2O+I2催化的过程。
、 (不必配平)
 (5)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致双氧水大量分解,应该采取的加热方式是 。
(5)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致双氧水大量分解,应该采取的加热方式是 。
 (选考--有机化学基础,13分)
(选考--有机化学基础,13分)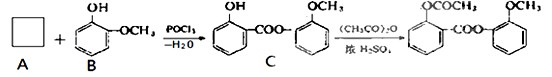
 学反应方程式表示)
学反应方程式表示)
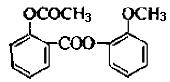
 同分异构体很多,写出属于酯类,且能与FeCl3反应显紫色的同分异构体的结构简式是
。
同分异构体很多,写出属于酯类,且能与FeCl3反应显紫色的同分异构体的结构简式是
。  ①该分子中两个Y原子之间的键型组合正确的是
①该分子中两个Y原子之间的键型组合正确的是
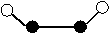 C. 1个σ键和1个π键 D.
仅2个σ键
C. 1个σ键和1个π键 D.
仅2个σ键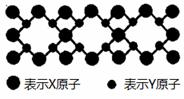 A. 该晶体属于分子晶体
A. 该晶体属于分子晶体 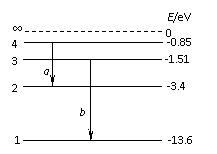 (2)如图所示为氢原子的能级图。当氢原子从n=4的能级跃迁到n=2的能级时,辐射出光子a;当氢原子从n=3的能级跃迁到n=1的能级时,辐射出光子b,则下列判断正确的是:___
___
(2)如图所示为氢原子的能级图。当氢原子从n=4的能级跃迁到n=2的能级时,辐射出光子a;当氢原子从n=3的能级跃迁到n=1的能级时,辐射出光子b,则下列判断正确的是:___
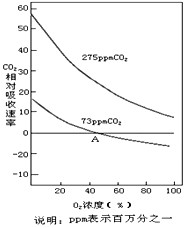
___ 加,两者增加的量相等,并可以累加。请回答以下问题:
加,两者增加的量相等,并可以累加。请回答以下问题: (4)为了验证上述氧浓度对绿色植物光合作用的影响,某同学设置了如下实验装置。请回答下列问题:
(4)为了验证上述氧浓度对绿色植物光合作用的影响,某同学设置了如下实验装置。请回答下列问题:
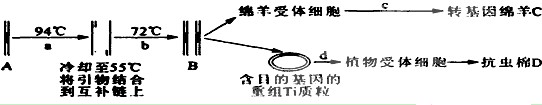
 其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。 TiCl4(l) + O2
(g) △H = +151 kJ·mol-1
TiCl4(l) + O2
(g) △H = +151 kJ·mol-1