0 123532 123540 123546 123550 123556 123558 123562 123568 123570 123576 123582 123586 123588 123592 123598 123600 123606 123610 123612 123616 123618 123622 123624 123626 123627 123628 123630 123631 123632 123634 123636 123640 123642 123646 123648 123652 123658 123660 123666 123670 123672 123676 123682 123688 123690 123696 123700 123702 123708 123712 123718 123726 447348
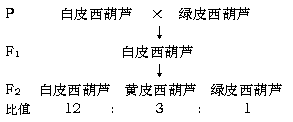
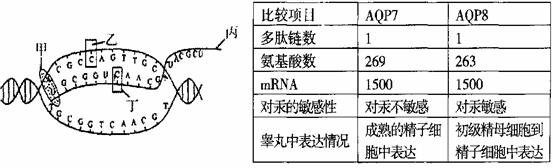
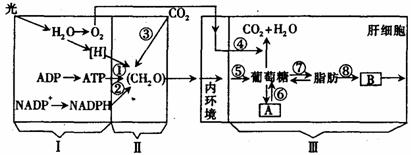
 (6分)菠菜是XY型性别决定且雌雄异株的植物,请回答下列问题:
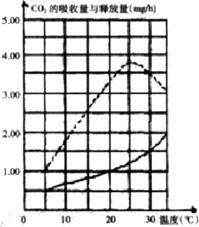
(6分)菠菜是XY型性别决定且雌雄异株的植物,请回答下列问题: 的吸收量,实线表示黑暗中线粒体对CO
的吸收量,实线表示黑暗中线粒体对CO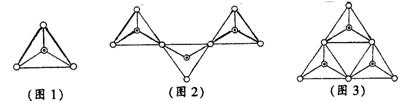 (16分)I(10分)已知地壳中含量第二的元素为硅,硅酸盐在自然界中分布极广,几乎在所有的硅酸盐矿物中,Si原子都和4个O原子结合成四面体的[SiO4]单元(图1),图中O表示“O”,⊙表示“Si-O”),[SiO4]单元既可以是独立的,也可以和其它四面体共用顶点连接成各种各样的链状结构(如图2)、环状结构(如图3)。
(16分)I(10分)已知地壳中含量第二的元素为硅,硅酸盐在自然界中分布极广,几乎在所有的硅酸盐矿物中,Si原子都和4个O原子结合成四面体的[SiO4]单元(图1),图中O表示“O”,⊙表示“Si-O”),[SiO4]单元既可以是独立的,也可以和其它四面体共用顶点连接成各种各样的链状结构(如图2)、环状结构(如图3)。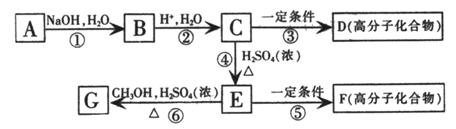
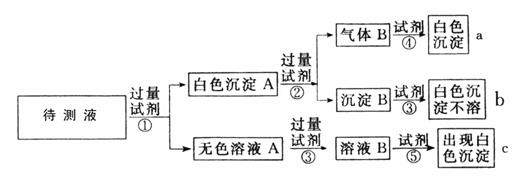 (14分)某无色溶液中含有K+、Cl-、OH-、CO32-、SO42-,为检验确认其中所含的各种阴离子,限用的试剂有:稀盐酸、稀硝酸、硝酸银溶液、硝酸钡溶液、澄清石灰水和酚酞试液,其中检验OH-的实验方法从略,已知检验其他阴离子的过程如下图所示:
(14分)某无色溶液中含有K+、Cl-、OH-、CO32-、SO42-,为检验确认其中所含的各种阴离子,限用的试剂有:稀盐酸、稀硝酸、硝酸银溶液、硝酸钡溶液、澄清石灰水和酚酞试液,其中检验OH-的实验方法从略,已知检验其他阴离子的过程如下图所示: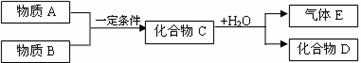
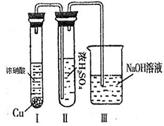 (2)若A为非金属单质,C是有色气体,D是一元强酸。
(2)若A为非金属单质,C是有色气体,D是一元强酸。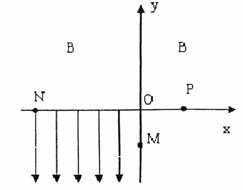 (20分)如图所示,在直角坐标系的第一、二象限内有垂直于纸面的匀强磁场,第三象限有沿y轴负方向的匀强电场;第四象限无电场和磁场。现有一质量为m、
(20分)如图所示,在直角坐标系的第一、二象限内有垂直于纸面的匀强磁场,第三象限有沿y轴负方向的匀强电场;第四象限无电场和磁场。现有一质量为m、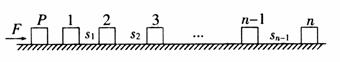 (18分)如图所示,在光滑的水平面上沿直线按不同的间距依次排列着质量均为m的滑块1、2、3、…、(n-1)、n,滑块P的质量也为m。P从静止开始在大小为F的水平恒力作用下向右运动,经时间T与滑块1碰撞,碰撞后滑块便粘连在一起,以后每经过的时间T就与下一滑块碰撞一次,每次碰撞后均粘连在一起,碰撞时间极短,每个滑块都可简化为质点,求:
(18分)如图所示,在光滑的水平面上沿直线按不同的间距依次排列着质量均为m的滑块1、2、3、…、(n-1)、n,滑块P的质量也为m。P从静止开始在大小为F的水平恒力作用下向右运动,经时间T与滑块1碰撞,碰撞后滑块便粘连在一起,以后每经过的时间T就与下一滑块碰撞一次,每次碰撞后均粘连在一起,碰撞时间极短,每个滑块都可简化为质点,求: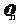 ;
;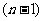 个滑块与第
个滑块与第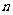 个滑块间的距离
个滑块间的距离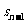 。
。