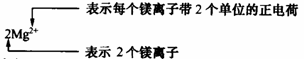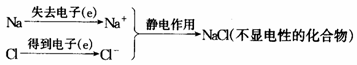4.化合价与离子符号的书写有一定的区别:
|
化合价 |
离子 |
|
|
表示方法 |
用+1、+2、-1、-2……表示标在元素符号的正上方(“1”不省) |
用+、2+、-、2-……表示标在元素符号右上角(“1”省去) |
|
实例 |
+1 -1-1 +2 Na、Cl、OH、Ca |
Na+、Mg2+、Al3+、Cl-、SO42- |
|
联系与区别 |
同种元素(或原子团)的化合价和离子电荷通常在数值上相等,位置不同,正、负号的写法不同。 |
3.化合价。
化合物均有固定的组成,即形成化合物的元素有固定的原子个数比,化学上用“化合价”表示原子间相互化合的数目。
(1)化合价的一般规律:
①化合价有正价和负价。
a.氧元素通常显 价;
b.氢元素通常显 价;
c.金属元素跟非金属元素化合时,金属元素显 价,非金属元素显 价;
d.一些元素在不同的化合物中可显不同的化合价。
②在化合物里正、负化合价的代数和为 。
③元素的化合价是元素的原子在相互形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为 。
(2)常见元素及原子团的化合价:
|
+1价 |
K、Na、H、Ag、NH4 |
+2价 |
Ca、Mg、Ba、Zn、Cu |
|
-1价 |
F、Cl、I、OH、NO3 |
-2价 |
O、S、SO4、CO3 |
1.化学式。用元素符号表示物质组成的式子叫化学式。
(1)化学式的意义(以H2O为例):
|
分类 |
意义 |
实例 |
|
宏观 |
①表示一种物质 |
水 |
|
①表不该物质组成元素 |
水是由H、O两种元素组成的 |
|
|
微观 |
①表示物质的一个分子 |
一个水分子 |
|
②表示物质的分子构成 |
每个水分于是由2个氢原子和1个氧原子构成 |
如:
写出下列符号的意义:
3Fe ,5Al2O3 ,2H2 .
写出下列化学语的符号:4个钠离子: ,2个氯气分子: ,氮气 , 4个硫酸分子: ,氧元素: ,3个碳酸钠分子:
3.离子与原子的区别和联系:
|
粒子种类 |
原子 |
离子 |
||
|
阳离子 |
阴离子 |
|||
|
区别 |
粒子结构 |
质子数=核外电子数 |
质子数>核外电子数 |
质子数<核外电子数 |
|
粒子电性 |
不显电性 |
显正电性 |
显负电性 |
|
|
符号 |
用元素符号表示如Na、Cl |
用阳离子符号表示如Na+、Mg2+ |
用阴离子符号表示如Cl-、S2- |
|
|
联系 |
阳离子  原子 原子  阴离子 阴离子 |
1.核外电子的排布。
(1)核外电子的分层排布:元素的原子核外的电子层最少有1层,最多有7层;第一层不超过个 电子,第二层不超过 个电子,最外层不超过 个电子(只有1个电子层的最外层不超过2个电子)。
(2)原子结构简图各部分的意义:
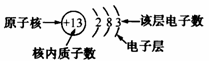
(3)相对稳定结构:最外层具有 电子(只有一个电子层的元素具有2个电子)的结构属于相对稳定结构。
(4)元素性质与元素最外层电子数的关系:
|
元素分类 |
最外层电子数 |
得失电子倾向 |
化学性质 |
|
稀有气体元素 |
8个(He为2个) |
不易得失、相对稳定 |
稳定 |
|
金属元素 |
一般 4个 |
易 最外层电子 |
不稳定 |
|
非金属元素 |
一般 个
|
易 电子 |
不稳定 |
(5)元素的性质,特别是元素的化学性质,是由 决定的。
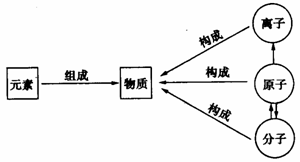
2.元素符号。
国际上统一用来表示元素的一种特定的化学符号。
(1) 意义:①表示一种元素;②表示这种元素的一个原子。
例:N表示的意义有: 和 。
如果在元素符号前面添加系数,就只表示该元素的原子个数,不能表示该元素。如H既表示氢元素又能表示一个氧原子,而2H只能表示 ;3Fe表示 ;若要表示5个镁原子可记为: ,7个氯原子可记为: 。
元素与原子的比较
|
|
元素 |
原子 |
|
区别 |
是宏观概念,只表示种类,不表示个数 |
是微观概念,既表示种类,又表示个数 |
|
适用范围 |
表示物质的宏观组成,如水是由氢元素和氧元素组成的 |
表示物质的微观构成。如1个水分子是由2个氢原子和1个氧原子构成 |
|
联系 |
元素是核电荷数相同的一类原子的总称 |
原子是元素的最小粒子 |
(2)书写:①由一个字母表示的元素符号要大写;①由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写。例如:钙 ,钠 ,钴 镁 ,铝 等。
(3)元素中文名称的特点:金属元素除“汞”以外都是“金”旁,例如:
非金属元素按单质在通常情况下的存在状态分别加“石”、“气”、“水”等偏旁,因此我们可以从它们的偏旁判断属于哪类元素。
 阳离子:带正电的离子
阳离子:带正电的离子