【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
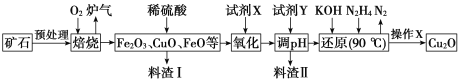
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式为________
(8)工业上用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)HCN(g)+3H2(g ) △H>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是___________(填字母序号)
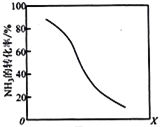
a.温度 b.压强 c.催化剂 d.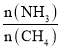
【题目】Na2O2具有漂白性和较强的氧化性,下面是某实验小组设计的过氧化钠性质探究实验。回答下列问题:
探究Na2O2与H2反应:
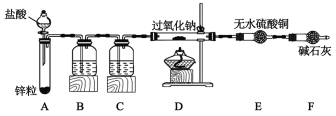
(1)装置B中所盛试剂的名称是___,其作用是___,为了简化实验,可用代替B和C装置___(填写装置名称和装置中所盛试剂的名称)。
(2)装入药品后,点燃D处酒精灯之前的操作是___。
(3)根据下表中的信息,完成对反应情况的探究。
步骤 | 现象 | 结论 |
点燃D处酒精灯 | D中Na2O2逐渐熔化,颜色由①___(填颜色变化),E处无明显现象。 | 加热条件下Na2O2与H2发生反应。 |
反应结束后,待D装置冷却后,取少量D中物质于试管中,加入适量水和几滴酚酞。 | ②___ | Na2O2反应后无剩余,Na2O2与H2反应的化学方程式为:③___。 |
探究Na2O2与水的反应:
(4)用脱脂棉包裹Na2O2粉末,然后滴几滴蒸馏水,发现脱脂棉燃烧起来,试分析其中的原因:___。
(5)有资料显示,Na2O2与水反应后的溶液中有H2O2,设计一个简单的实验证明H2O2的存在:___。
【题目】如图是元素周期表的一部分,表中列出了①~⑧元素。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
用元素符号或化学式填写下列空格:
(1)①~⑦元素中,原子半径最大的元素是_______(填元素符号),最高价氧化物对应水化物中酸性最强的物质是____________________(填酸的化学式)。
(2)①的气态氢化物的电子式为_________________。
(3)①~⑧元素中,③的氢氧化物的碱性______④的氢氧化物(“大于、小于或等于”);②的氢化物稳定性______⑦的氢化物(“大于、小于或等于”)。
【题目】丙烯等不饱和烃在有机化工领域有重要的用途,工业上常采用“丙烷脱氢法”制取丙烯,反应的原理为:C3H8(g)![]() C3H6(g)+H2(g) ΔH=+123kJ/mol
C3H6(g)+H2(g) ΔH=+123kJ/mol
回答下列问题:
(1)在石油工业中可通过___工艺获得丙烯等不饱和烃(填一种工艺的名称)。
(2)已知:
化学键 | C-H | C-C | C=C | H-H |
键能(kJ/mol) | 412 | 348 | a | 436 |
表中的a=___。
(3)工业上进行该反应时,常在丙烷中掺入稀有气体作为稀释剂,在体积可变的反应容器中,维持恒温,并使总压强恒定为0.1MPa,掺入稀有气体作为稀释剂的优点是___,试从平衡角度加以解释___。
(4)在某密闭容器中充入适量的丙烷,测得丙烷的转化率随温度和压强变化如图所示:
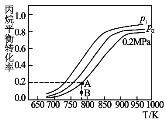
①压强p1___p2(填“>”、“<”或“=”)。
②图中A点平衡常数Kp=___(用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留三位有效数字)。
③B点若达到A点所示的平衡状态则在建立平衡过程中v正___ v逆(填“>”、“<”或“=”)。
④写出一条提高丙烷平衡转化率的措施___。
【题目】某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图
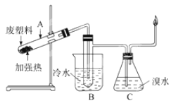
加热聚丙烯废塑料得到的产物如表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔:
![]()
写出反应(2)的化学方程式__________________________________。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有____种。
(3)经锥形瓶C中溴水充分吸收,剩余气体经过干燥后的平均相对分子质量为_______。