题目内容
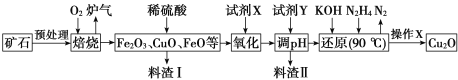
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
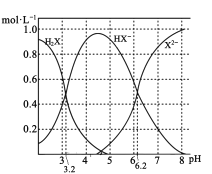
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式为________
(8)工业上用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)HCN(g)+3H2(g ) △H>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是___________(填字母序号)
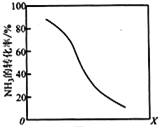
a.温度 b.压强 c.催化剂 d.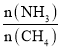
【答案】SO2 2∶1 空气或氧气 3.7≤pH<4.8 ad 4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4K2SO4+6H2O 防止Cu2O被空气中氧气氧化 2Cu-2e-+2OH-=Cu2O+H2O bd
2Cu2O+N2↑+4K2SO4+6H2O 防止Cu2O被空气中氧气氧化 2Cu-2e-+2OH-=Cu2O+H2O bd
【解析】
硫化铜矿石(含 CuFeS2、Cu2S等)预处理后与氧气焙烧:2CuFeS2+4O2 ![]() Cu2S+3SO2+2FeO、Cu2S+2O2
Cu2S+3SO2+2FeO、Cu2S+2O2![]() 2CuO+SO2,部分FeO被氧化为Fe2O3,得到相应的金属氧化物和SO2,加入稀硫酸溶解金属氧化物,得到含有Cu2+、Fe2+、Fe3+的酸性溶液,加入试剂X将Fe2+氧化为Fe3+,加入试剂Y调节pH3.7~4.8沉淀Fe3+,过滤,将滤液用KOH、N2H4还原,反应为:4CuSO4+N2H4+8KOH
2CuO+SO2,部分FeO被氧化为Fe2O3,得到相应的金属氧化物和SO2,加入稀硫酸溶解金属氧化物,得到含有Cu2+、Fe2+、Fe3+的酸性溶液,加入试剂X将Fe2+氧化为Fe3+,加入试剂Y调节pH3.7~4.8沉淀Fe3+,过滤,将滤液用KOH、N2H4还原,反应为:4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4KSO4+6H2O,过滤,洗涤、隔绝空气烘干,制得Cu2O。
2Cu2O+N2↑+4KSO4+6H2O,过滤,洗涤、隔绝空气烘干,制得Cu2O。
(1)根据流程,矿石与氧气高温反应得到金属氧化物和SO2;Cu2S与O2反应为Cu2S+2O2![]() 2CuO+SO2,氧化剂为氧气,还原剂为Cu2S,氧化剂与还原剂的物质的量之比为2:1;
2CuO+SO2,氧化剂为氧气,还原剂为Cu2S,氧化剂与还原剂的物质的量之比为2:1;
(2)若试剂X是H2O2溶液,将Fe2+氧化为Fe3+;酸性条件下,O2也可将Fe2+氧化为Fe3+,而氧气或空气价格远低于过氧化氢,故可用氧气或空气替代;
(3)加入试剂Y的目的是调节pH完全沉淀Fe3+,但不沉淀Cu2+,根据表中数据可知,pH范围为:3.7≤pH<4.8;
(4)还原过程中发生的反应是4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4KSO4+6H2O,提高N2H4的转化率,则N2H4要充分反应;
2Cu2O+N2↑+4KSO4+6H2O,提高N2H4的转化率,则N2H4要充分反应;
a.不断搅拌,增加N2H4与溶液的接触面,使得N2H4充分反应,a符合题意;
b.增大通入N2H4的流速,有部分N2H4来不及反应,转化率会降低,b不符合题意;
c.减少KOH的进入量,该反应需要消耗碱,如果没有碱,反应速率减慢,转化率降低,c不符合题意;
d.减小通入N2H4的流速,能够使得N2H4反应更加充分,转化率增加,d符合题意;
综上ad符合题意;
(5)根据分析N2H4制备Cu2O的化学方程式为4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4KSO4+6H2O;
2Cu2O+N2↑+4KSO4+6H2O;
(6)操作X为过滤,洗涤、隔绝空气烘干,制得Cu2O,因为Cu2O可以被O2氧化,在加热条件下易被空气氧化,故烘干过程要隔绝空气;
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,阳极发生氧化反应,电极反应式为:2Cu-2e-+2OH-=Cu2O+H2O;
(8)根据图示,NH3的转化率随着X的增加而减小;
a该反应为放热反应,升高温度,平衡正向移动,NH3的转化率增加,与图像不符,a不符合题意;
b.该反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,NH3的转化率减小,与图像相符,b符合题意;
c.催化剂增加化学反应速率,但是不影响平衡移动,NH3转化率不变,与图像不符,c不符合题意;
d. 增加,平衡正向移动,但是NH3的转化率减小,与图像相符,d符合题意;
增加,平衡正向移动,但是NH3的转化率减小,与图像相符,d符合题意;
综上bd符合题意。