��Ŀ����
����Ŀ��Na2O2����Ư���Ժͽ�ǿ�������ԣ�������ijʵ��С����ƵĹ�����������̽��ʵ�顣�ش��������⣺
̽��Na2O2��H2��Ӧ��
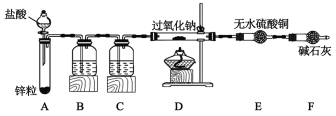
��1��װ��B����ʢ�Լ���������___����������___��Ϊ�˼�ʵ�飬���ô���B��Cװ��___����дװ�����ƺ�װ������ʢ�Լ������ƣ���
��2��װ��ҩƷ��ȼD���ƾ���֮ǰ�IJ�����___��
��3�������±��е���Ϣ����ɶԷ�Ӧ�����̽����
���� | ���� | ���� |
��ȼD���ƾ��� | D��Na2O2���ۻ�����ɫ�ɢ�___������ɫ�仯����E������������ | ����������Na2O2��H2������Ӧ�� |
��Ӧ������Dװ����ȴ��ȡ����D���������Թ��У���������ˮ�ͼ��η�̪�� | ��___ | Na2O2��Ӧ����ʣ�࣬Na2O2��H2��Ӧ�Ļ�ѧ����ʽΪ����___�� |
̽��Na2O2��ˮ�ķ�Ӧ��
��4������֬�ް���Na2O2��ĩ��Ȼ��μ�������ˮ��������֬��ȼ���������Է������е�ԭ��___��
��5����������ʾ��Na2O2��ˮ��Ӧ�����Һ����H2O2�����һ����ʵ��֤��H2O2�Ĵ��ڣ�___��
���𰸡�NaOH��Һ ��ȥ�����е�HCl ʢ�м�ʯ�ҵĸ���ܣ���ʢ�м�ʯ�ҵ�U�ιܣ� ��Aװ���еķ�Һ©��������ͨ��һ��ʱ�����������װ��F��ĩ���ռ������������䴿�� ����ɫ��Ϊ��ɫ �Թ��������ݲ�������Һ��� Na2O2+H2![]() 2NaOH Na2O2��ˮ��Ӧ�ų��������Ҹ÷�Ӧ�Ƿ��ȷ�Ӧ���ų��������ﵽ����֬���Ż�� ȡ����Na2O2��ˮ��Ӧ�����Һ���Թ��У�����MnO2��ĩ�����۲쵽��Һ��������ð������֤����H2O2����
2NaOH Na2O2��ˮ��Ӧ�ų��������Ҹ÷�Ӧ�Ƿ��ȷ�Ӧ���ų��������ﵽ����֬���Ż�� ȡ����Na2O2��ˮ��Ӧ�����Һ���Թ��У�����MnO2��ĩ�����۲쵽��Һ��������ð������֤����H2O2����
��������
װ��AΪ����װ�ã�װ��B�dz���װ�ã�װ��C�Ǹ���װ�ã�װ�м�ʯ�ҵĸ���ܿ��Զ�װ��A���������������Ӹ�������ã����ʵ��ԭ�������ʵ����ʷ������
��1�����ɵ������л����Ȼ����ˮ������Bװ����Ϊ����������Һ���ڳ�ȥ�Ȼ��⣬Cװ����ΪŨ�������ڳ�ȥˮ��������ʯ�ҿ�ͬʱ�����Ȼ����ˮ�������ʿ���ʢ�м�ʯ�ҵĸ���ܴ���B��C��װ�ã�
��2�������������ϼ��Ȼᷢ����ը���ʵ�ȼD���ƾ���ǰ����Ҫ��ͨ��һ��ʱ�������������װ�õ�ĩ���ռ��ų�����������鴿�����ų������崿���ˣ��ٵ�ȼD���ľƾ��ƣ�
��3������E������������֪����������������Ӧ��ˮ���ɣ���˲²���߷����˻��Ϸ�Ӧ������NaOH���ʢٵ�����Ϊ����ɫ��Ϊ��ɫ�����ݽ���Na2O2��ʣ�࣬��֪�ڵ�����Ϊ�Թ��������ݷų���ֻ����Һ��죬����ȷ��Na2O2��������Ӧ�ķ���ʽΪ��Na2O2+H2![]() 2NaOH��
2NaOH��
��4��Na2O2��ˮ��Ӧ�����������ɣ���֬���ܹ�ȼ�գ�˵��Na2O2��ˮ��Ӧ�Ƿ��ȷ�Ӧ���ų��������ﵽ����֬���Ż�㣻
��5����Ӧ�����Һ���������H2O2�������MnO2�ɴ�ʹH2O2�ֽ⣬��Һ�л������ݲ�����

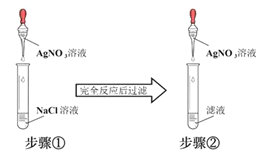
 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�������й�ʵ���������ȷ���ǣ� ��
ѡ�� | ʵ������ | �������� |
A | ��ƽ����ϵFeCl3+3KSCN | ��Һ��ɫ���Ա�dz |
B | ��NaOH��Һ�ζ����ᣨ��̪��ָʾ�������յ� | ��Һ�ɺ�ɫ��Ϊ��ɫ |
C | ��������ͨ�뵽���Ը��������Һ�� | ���Ը��������Һ��ɫ��SO2���л�ԭ�� |
D | ��������һ�������Ҵ��� | �Ƹ���Һ���Ͼ��ҷ�Ӧ |
A.AB.BC.CD.D
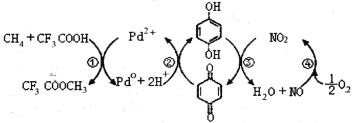
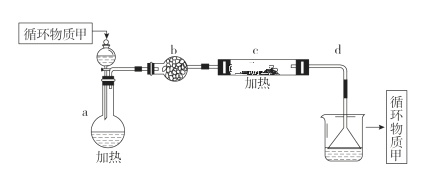
����Ŀ��ijЩ�Ͼ����Ͽɲ������з����������������ϸ���������ǿ�ȣ�ʹ�������õ����ʣ�ʵ��װ����ͼ
���Ⱦ۱�ϩ�����ϵõ��IJ��������
���� | ���� | ���� | ��ϩ | ��ϩ | �� | �ױ� | ̼ |
��������(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
(1)�Թ�A�в������ж�����;��������ת���Ϳ���ȡ�߾������Ȳ��
![]()
д����Ӧ(2)�Ļ�ѧ����ʽ__________________________________��
(2)�Թ�B�ռ����IJ�Ʒ�У���ʹ���Ը��������Һ��ɫ�����ʣ���һ�ȴ�����____�֡�
(3)����ƿC����ˮ������գ�ʣ�����徭��������ƽ����Է�������Ϊ_______��